Los metales forman parte de nuestra vida cotidiana y se encuentran en todas las acciones de nuestra existencia: desde la lata de bebidas, hasta los cubiertos, pasando por los cables eléctricos, o incluso nuestros teléfonos móviles. Ningún material ha sido tan importante para la historia del hombre como el metal.
El progreso de la agricultura, la guerra, el transporte e incluso el arte o la ciencia, también la cocina hubiera sido imposible sin ellos. Pero para poder utilizarlos, había que resolver muchos problemas técnicos: ¿Cómo reconocerlos? ¿Dónde encontrarlos? ¿Cómo detectarlas cuando a menudo están en combinación con otras sustancias? ¿Cuáles son sus propiedades y cuál es la mejor manera de utilizarlas?
¿Sabías que los metales tienen una historia? Fueron descubiertos en diferentes momentos y su uso siempre transformará la sociedad circundante.
Indice De Contenidos
- 1 Historia
- 2 Origen
- 3 Historia De La Metalurgia
- 4 ¿Qué Son Los Metales?
- 5 Características de Los Metales
- 6 Propiedades
- 7 Clasificación
- 8 Tipos de Metales
- 9 Sus Usos
- 10 Conductores
- 11 Pesados
- 12 Alcalinos
- 13 Oxidantes
- 14 De Transición
- 15 No Ferrosos
- 16 Térreos
- 17 Alcalinotérreos
- 18 Líquidos
- 19 Nobles
- 20 Dúctiles
- 21 Metales Más Ligeros
- 22 Duros
- 23 Blandos
- 24 Maleables
- 25 Cromados
- 26 Galvanizados
- 27 Blancos
- 28 Halógenos
- 29 No Metales
- 30 Tabla Periódica
- 31 Aleaciones
- 32 Ejemplos
- 33 Reciclables
Historia
Si hoy en día, 86 metales están incluidos en la tabla de Mendeleev, sólo siete fueron conocidos y aislados hasta la Edad Media:
- Oro, descubierto alrededor del año 6000 a.C.
- Cobre, descubierto alrededor del 4000 a.C.
- Plata, descubierto alrededor del 3500 a.C.
- Plomo, descubierto alrededor del 3500 a.C.
- Estaño, descubierto alrededor del año 3000 a.C.
- Hierro, descubierto alrededor del año 1500 a.C.
- Mercurio, descubierto alrededor del año 750 a.C.
La fecha de su descubrimiento es aproximada y su uso se extenderá por todo el mundo con velocidades variables. La mayoría de ellos aparecen en Mesopotamia, durante uno de los brotes de civilización. Cabe señalar que otros metales en forma no pura ya se utilizaban en la antigüedad o en el siglo XIX, y en la Edad Media, como el zinc o el níquel. Los herreros todavía no habían logrado aislarlos: la utilización ha sido de forma periférica, utilizando por ejemplo el zinc contenido en la calamina para crear latón (cobre + zinc).
Los metales son y fueron tan importantes para la humanidad que a menudo se comparan con los siete pilares de la civilización e incluso los períodos de la historia llevarán los nombres de algunos de ellos (Edad de Hierro, edad del cobre).
La metalurgia y los primeros usos del metal aparecieron en el Medio Oriente en el siglo XIX, durante el quinto milenio antes de Cristo. Los pueblos neolíticos de la Media Luna Fértil luego se interesan por ciertas “piedras” con propiedades particulares: brillan cuando se frotan y tienen un tacto agradable.
Se utilizaban en primer lugar para fines decorativo, con oro, plata y cobre. Presentes en su estado natural, los ancianos sólo tenían que para bajar a recoger lo que todavía consideran como “piedras” de la misma manera que el mármol o piedra caliza.
Pero a diferencia del sílex, por ejemplo, estos metales son raros y esta rareza les añadirá valor. Descubren rápidamente que son maleables, es decir, que puede deformarse sin romperse, a diferencia de otras piedras. También reaccionan al fuego por deformación y fusión y puede licuarse antes de volver a solidificarse adoptando de formas específicas. Para asegurar esta fusión, los ancianos logran obtener calor suficientemente fuerte por medio de un fuego de leña (por ejemplo, para el plomo) y más tarde en un el horno de alfarería.
El metal puede ser moldeado por fundición, fundición a la cera perdida y martilleo, o incluso por estas tres técnicas combinadas. Las excavaciones de esta manera entregaron los moldes en piedra o arcilla en forma de joyas o herramientas. La mejora de los hornos y de los combustibles (utilizando carbón vegetal) conducirá al posibilidad de alcanzar temperaturas más altas y por lo tanto de poder trabajar con otros metales. A partir del tercer milenio, el metalúrgico también puede purificar estos metales preciosos de la siguiente manera: derritiendo el mineral en un florero poroso para quitar el impurezas.
Origen
Los primeros herreros utilizaban los metales sin deducir sus propiedades. Históricamente, la tecnología precedió a la ciencia y es mucho más tarde que la teoría científica llegará para reforzar lo que el artesano ha practicado intuitivamente durante siglos. Naturalmente, el herrero tratará de mezclar estos metales fundidos y hacer aleaciones. Señala que las mezclas obtenidas no sólo varían en color según las dosis, sino que transforman también las propiedades de los metales, incluida la resistencia.
Las primeras aleaciones son naturales como el oro y la plata que se mezclaron para dar el electrum. Otras aleaciones son el fruto del trabajo humano, como el bronce por supuesto (cobre y estaño o latón, cobre con zinc contenida en la calamina). El bronce tiene muchas ventajas sobre el cobre puro: es más resistente si el de estaño es correcta; también es más fácil de verter que el cobre y su punto de fusión.
La fusión es más baja, requiere menos combustible. Las proporciones de la aleación (90% de cobre, 10% de estaño) mencionados en los textos fueron confirmados por los análisis, la influencia fue tan grande que un período de la prehistoria (protohistoria) fue llamado la “edad de bronce” en referencia a esta aleación (de unos 2500 a 800 a.C.). El nombre “bronce” vendría de Brindisi, una ciudad en Italia, famosa en la antigüedad por su metalurgia del bronce. (Ver Articulo: Amazonia)
Hay que tener en cuanta, la cronología de estas edades varía mucho y depende en gran medida de la ubicación. Así, en Mesopotamia, se han encontrado objetos de bronce que datan de 5.000 años antes de Cristo. El bronce penetrará más de 2000 años después en Europa. Utilizado durante casi dos milenios, el bronce será destronado por el hierro.
Poco a poco, los metales se distinguen de “otras” piedras y una lista de siete metales será finalmente adoptada. Siete, un número rico en significado. En las civilizaciones donde la forma de pensar es mágico-religioso, estos metales se acercarán a los planetas, a los que corresponden, según los misteriosos vínculos.
Estos vínculos se verán reforzados por los informes de que los dioses del panteón greco-romano los nutriría: los metales son percibidos como metales con rastros divinos abandonados en la tierra, y aquellos que los usan están cubiertos de un aura mística.
La especialización de los oficios lleva a los herreros a adquirir los conocimientos técnicos que desean preservar y transmitir sólo a ciertas personas con información privilegiada: es cierto que las armas metálicas traen la supremacía en los campos de batalla, con los de bronce reemplazando a los de piedra, y los de bronce hechos de hierro. El secreto militar estará bien guardado
Historia De La Metalurgia
La metalurgia es el conjunto de industrias y técnicas que garantizan la fabricación de metales. Su desarrollo cambiará profundamente la historia de la humanidad. Requiere un control perfecto del fuego. Cabe señalar que las etapas de la metalurgia pueden coexistir al mismo tiempo con diferentes técnicas según los distintos países y las regiones que se estudien, desde entonces se han descubierto metales y aleaciones.
Es en el Medio Oriente en el cuarto milenio se descubrió el bronce, pero Europa Occidental sólo entrará en la era del bronce hasta 2000 años después que el medio oriente. Pensemos también en América, que sólo conocerá el hierro con la llegada de los conquistadores a principios de 1900. (Ver Articulo: Temperatura)
1. Edad de Cobre, a partir de 4000 A.C.
Además del oro, inicialmente trabajado por martilleo, otro metal puede ser encontrado fácilmente en la naturaleza y que existe en su estado puro es el cobre. Algunas comunidades neolíticas comenzaron ya en el quinto milenio a.C. usar cuchillos y hoces de cobre en lugar de piedra cortada. Estas herramientas tienen la ventaja de durar más tiempo y estar más afilados.
Este período intermedio entre la Edad de Piedra (cuando todas las armas y herramientas son de sílex) y la primera aleación (la Edad del Bronce) se llama el período calcolítico, calcos de cobre y litos, piedra. Un accidente puede haber llevado al descubrimiento de sus propiedades.
Podemos imaginar que un objeto de cobre (un mineral, o incluso una pieza de joyería, por ejemplo) cayó en una hoguera, lo que provocó una fusión; este posteriormente se enfriará y adoptará una nueva forma al volverse más resistente y afilado.
El uso del fuego y del metal permite, por tanto, dos avances significativos en el desarrollo de la metalurgia: fundición, es decir, vertido en moldes preparados, y la fundición de minerales para extraer este metal. Se han descubierto objetos hechos de cobre fundido por arqueólogos en Irán y se remontan al año 3800 a.C. (Ver Articulo: Tunguska)
2. Edad de Bronce, alrededor de -1,800 a – 800 a.C.
Un incidente similar alrededor de una chimenea también puede haber llevado a la primera aleación y a nosotros a descubrir que una hoja de bronce tiene un borde más afilado que el cobre. Esta mezcla de cobre y estaño será tan importante que todo un período de civilización llevará su nombre: la Edad de Bronce.
La tecnología de bronce fue desarrollada por primera vez en Oriente Medio: en Sumer y Ur, alrededor de 2800 antes de nuestra era, en Anatolia poco después. Luego se propaga de forma espasmódica hacia el Este, en el Valle del Indo alrededor del 2500 a.C., y hacia el oeste a través de Europa, hasta alrededor del año 2000 a.C. En China, la técnica de la aleación alcanzará un nivel de sofisticación sin precedentes.
Desde 1500 a.C., la dinastía Shang producirá objetos de bronce excepcionales. Sin embargo, tengamos en cuenta que sólo las clases dominantes utilizan el bronce de lujo o como arma de élite. El agricultor o artesano vendrá a emplear durante mucho tiempo objetos cotidianos de sílex, ya que la Edad de Piedra sobrevivía en el corazón mismo de la Edad de Bronce. La aleación realmente se extendió después de 1500. (Ver Articulo: Electron)
3. Edad de Hierro, alrededor del 1200 a.C. en el mundo mediterráneo, alrededor del 800 a.C. y 700 a.C. en el norte de Europa.
El siguiente desarrollo en la metalurgia se refiere al hierro, que es sin duda el metal más importante y abundante en la superficie de la tierra, pero mucho más difícil de trabajar que el cobre, la plata o el estaño. De hecho, su temperatura de fusión es más alta (alrededor de 1.500°C comparado con 1000°C para cobre). Durante mucho tiempo, los herreros se contentaron con calentarlo y martillarlo para cazar impurezas.
En su forma simple, el hierro es menos duro que el bronce, y por lo tanto no se utiliza inicialmente como un arma. Algunos objetos de hierro que datan de antes del año 2000 a.C. han sido encontrados por arqueólogos en Asia Menor (perlas, un anillo, espadas), pero no es hasta el año 1500 antes de Cristo que el trabajo del hierro se extiende. Los hititas fueron los primeros en hacerlo para trabajar, en Anatolia, alrededor del año 1250 a.C.
De este período datan los primeros hornos bajos, que se modelan a partir de los hornos de los alfareros. Al calentarse, eliminan el oxígeno del mineral y obtienen así un metal más puro. Muy a principios de la historia, se descubre que el hierro puede mejorarse mucho si se calienta en un horno de carbón (que contiene carbono), y durante la cocción parte de este carbono es transferido a la plancha.
El efecto es aún más importante si la temperatura se reduce rápidamente, mediante por ejemplo, el arrojamiento del metal fundido al agua: ¡es acero endurecido! Puede trabajarse (o “forjarse”) como el hierro blando, y será más fino y resistente, ya que elimina la escoria por martilleo. Las técnicas de fabricación y el uso del acero serán cada vez más importantes a diferentes tasas dependiendo de la región.
Pero hasta ahora, nos hemos conformado con calentar la plancha y martillarla y nunca derretirla. De hecho, su punto de fusión (1528° C) es demasiado alto para los hornos primitivos, que apenas pueden alcanzar los 1300° C. Los chinos muy pronto logran desarrollar un horno lo suficientemente caliente como para alcanzar la temperatura de fusión, que dará el hierro fundido (alrededor del año 513 a.C.).
Lo utilizan en particular para los pilares de pagodas y por lo tanto están más de mil años por delante del mundo occidental, ya que apenas se inaugurará esta técnica en la Inglaterra del siglo XII. (Ver Articulo: Taiga)
4. Desarrollo De La Metalurgia
Los altos hornos aparecieron en Occidente a finales de la Edad Media y permitieron obtener la fundición de hierro, es decir, la fusión de una aleación de hierro y carbono (2 a 5%). Temperaturas superior a 1500°C se puede obtener por medio de fuelles, accionados por ruedas hidráulicas. Estos altos hornos se activan primero con carbón, que es raro y difícil de producir, y luego con coca, desarrollado en 1709 por un inglés, Abraham Darby y utilizado en nuestras regiones desde 1826 en la fábrica de John Cockerill.
5. Encharcamiento Y Laminación
En 1783 y 1784, Henry Cort (1740-1800), un herrero inglés, presentó dos patentes de importancia duradera en la historia de la metalurgia.
- La primera se refiere a una técnica conocida como “charco”: es un horno hecho que agita el hierro fundido para facilitar la mezcla de aire y metal. A diferencia de la fundición quebradiza, este metal obtenido es más sólido y maleable, lo que le resultará útil en el desarrollo industrial.
- La segunda patente se refiere a una máquina para descargar piezas de metal fundido entre rodillos ranurados. Logra obtener barras manejables sin el laborioso proceso de martilleo. Su dispositivo está en el origen de los trenes de laminación, las fábricas estándares de la industria siderúrgica.
A finales del siglo XVIII se desarrollaron los primeros laminadores. Son los que permitirá triturar barras de hierro rojo (+/- 1250°C) para transformarlas en láminas delgadas y planas. La industria pesada valona (minería, siderurgia, metalurgia, vidriería, etc.) ha experimentado un fuerte crecimiento. (Ver Articulo: Puntos Cardinales)
En el siglo XIX, especialmente en las cuencas de Lieja y Charleroi. Bélgica era entonces la primera nación industrializada del continente. Sin embargo, la disminución comienza en la primera parte del siglo XX. Los primeros cierres de minas en 1958 y más tarde la industria siderúrgica (que, sin embargo, ha sido completamente modernizada y restaurada), ha provocado una crisis importante en Valonia.
En 2007, China produjo un tercio de la producción mundial de acero y atrajo el 50% de las exportaciones de mineral de hierro. Los beneficios de todas las empresas siderúrgicas chinas alcanzaron el 17 mil millones de euros en 2007. Hoy en día, se está investigando mucho sobre los tratamientos que se aplican a los metales más que en su preparación, especialmente sin usar altos hornos.
De esta revisión de la evolución de la metalurgia, se desprende que las técnicas de extracción los metales se han refinado a lo largo de la historia, lo que ha llevado al descubrimiento de otros elementos. La aplicación de estos descubrimientos será lenta y a diferentes velocidades dependiendo de la región. Tengamos en cuenta que las aplicaciones científicas de los procesos a menudo tardan mucho tiempo en desarrollarse después de la técnica.
¿Qué Son Los Metales?
Los estados de la materia, es en el suelo, en forma de minerales, donde se encuentran los metales. A veces se hayan en su estado puro, pero la mayoría de las veces se mezclan con otros elementos: por ejemplo, la mayoría de los minerales de hierro son un compuesto químico de hierro, oxígeno y silicio. Para lo que debe estar separada y libre de otros elementos. ¿Cómo hacer esto?
Nosotros utilizamos principalmente un proceso llamado “fusión” que se lleva a cabo en un alto horno que puede alcanzar altas temperaturas. El metal se funde y, una vez que se ha convertido en líquido, puede aislarse más fácilmente. y crear una sustancia “pura”.
Características de Los Metales
Destacamos algunas de las principales diferencias que distinguen a los metales de los no metales:
- En primer lugar están las propiedades químicas: los metales tienen una densidad superior a los
no metálicos. - También difieren en su apariencia: los metales son brillantes, mientras que los no metales no son brillantes, pueden ser opacos o transparentes. Con la excepción del mercurio, todos los metales son presentes en forma sólida a temperatura ambiente, pero puede cambiar a líquido si se está calentando.
- También difieren en sus propiedades físicas y mecánicas: los metales son maleables en diferentes grados, lo que significa que pueden ser golpeados con hojas finas, así que los no metales son muy frágiles y difícilmente pueden ser transformados. A diferencia de los no metales, los metales son dúctiles, es decir, se pueden estirar en alambres.
- También son muy buenos conductores de electricidad y calor, mientras que los no metales son a menudo aislantes (pero no siempre: el agua, nuestros cuerpos son eléctricamente conductores).
Propiedades
Además de dos propiedades mecánicas (resistencia a la tracción, dureza y resistencia a penetración) hay seis propiedades de los metales:
- Primero hay un fusible: Un cuerpo es fusible si, por calor, puede pasar de estado sólido en estado líquido. En el caso de los primeros metales (oro, cobre, plata), antiguamente se buscaba llegar a un calor suficiente sobre un fuego de leña para licuarlo; a partir de entonces, la mejora del uso del carbón vegetal, permitirá lograr los siguientes objetivos: lograr temperaturas más altas y así fundir otros metales más resistentes
- Luego está la moldeabilidad: un cuerpo es moldeable cuando, en estado líquido, puede ser enfriado y se solidifica en un molde tomando su forma.
- Todavía hay maleabilidad: a diferencia de las piedras, los metales no se rompen cuando son golpeados, se deforman manteniendo la nueva forma que han adquirido. Maleabilidad es la razón por la que puede laminar (apisonadora) un material, forjarlo (martillar), o cortar un metal más o menos fácilmente.
- La ductilidad se refiere a la capacidad de un material de deformarse plásticamente sin romperse para formar hilos en particular. Si resiste bien, se le llama dúctil, de lo contrario se le llama frágil.
- Finalmente, hay conductividad térmica o eléctrica, lo que significa que los metales transmiten calor o corriente eléctrica en diferentes grados.
- Los metales todavía se caracterizan por su densidad. De hecho, por el mismo volumen los cuerpos no tienen el mismo peso. La plata tiene una densidad más baja que el del oro: por ejemplo, el de la plata es de 10kg/dm3 mientras que el peso del oro es de 19 kg/dm3.
Clasificación
Los elementos se organizan en la tabla periódica a partir de la clasificación por el aumento de Z y teniendo en cuenta los orbitales atómicos ocupados (para seguir con una Clasificación periódica en papel): La línea representa un período correspondiente a un valor dado de n (energía promedio).
La columna corresponde a una terminación electrónica idéntica que define un grupo o familia química para n> 1 (n s1 alcalino n s2: alcalino terroso, n s2n p5: halógenos) porque el comportamiento químico está determinado por los electrones periféricos. Entonces podemos tener una visión de la clasificación periódica en términos de bloques cuyo número depende de la última subcapa ocupada definida por el número cuántico l.
La noción de familia química (importancia de la terminación electrónica) se refleja en la periodicidad de ciertas propiedades (densidad electrónica promedio = Z / volumen del átomo, potencial de la 1ª ionización).
El número de la columna indica al mismo tiempo el número de electrones periféricos: por ejemplo, los elementos N, P, As, Sb pertenecen al grupo V y todos tienen 5 electrones en su capa más externa (s2p3).
La separación entre metales y no metales es por una diagonal que pasa a través de los elementos B, Si, (Ge, As), (Sb, Te). A la izquierda de la diagonal están los metales, a la derecha están los no metales. Los elementos en las diagonales son semi-metales. La mayoría de los elementos son por lo tanto metales. Las principales diferencias son:
- Metales: buenos conductores, maleables, dúctiles, óxidos básicos con alto punto de fusión.
- No metales: aislantes, frágiles, óxidos de ácido con bajo punto de fusión
- Semi-metales: la conductividad aumenta con la temperatura, frágil, óxidos anfóteros. (Ver Articulo: Coniferas)
Tipos de Metales
-
Ferrosos
Los metales ferrosos se definen como aquellos metales que contienen hierro. El Hierro, metal tenaz y maleable, utilizado para parrillas de jardín, puertas, cercas. Hierro fundido, una aleación de hierro y carbono, utilizada para radiadores, barandas y ciertas tuberías. Acero suave, una mezcla de hierro y carbono, utilizado en la construcción en forma de vigas o láminas, que se encuentra en rejillas, puertas, contraventanas. Todos estos materiales deben protegerse del oxígeno y la humedad.
Las aleaciones ferrosas que contienen carbono se denominan generalmente hierro o acero y pueden contener otros elementos, desde aluminio hasta vanadio, según sus especificaciones. Estos metales son generalmente elegidos por sus propiedades mecánicas.
Los ingenieros y diseñadores pueden estar interesados en su resistencia, tenacidad, ductilidad, soldabilidad, elasticidad, corte y límites de expansión térmica, que describen cómo se comportará un material bajo factores estresantes específicos. En metales ferrosos, el hierro y el acero son los materiales de moldeo más comunes. (Ver Articulo: Geografia)
-
Preciosos
Un metal precioso es un material que pertenece a la clase química de los metales y cuya principal especificidad es representar un gran valor económico.
A diferencia de los metales nobles, un nombre que agrupa los metales con propiedades fisicoquímicas específicas, el calificador de preciosos solo depende del valor de mercado y, por lo tanto, puede aplicarse o retirarse de acuerdo con las fluctuaciones que este último conoce.
Por lo tanto, varios criterios basan el valor de un metal precioso: por un lado, la utilidad de las propiedades (físicas y químicas) que posee, por otro lado, su rareza. De hecho, la rareza de un metal cuyas propiedades no serían útiles para el hombre no aumentaría su valor. Por el contrario, la abundancia de un metal disminuye su valor de mercado, independientemente de sus propiedades.
Lista de metales preciosos
- oro
- plata
- platino
- rodio
- escandio
- paladio
- rutenio
- osmio
- iridio
-
Radiactivos
Un elemento químico puede transformarse en otro elemento por una reacción nuclear. Esta definición moderna fue introducida por Robert Boyle en 1661. De hecho, una reacción química involucra los enlaces entre los electrones externos de los átomos, mientras que una reacción nuclear modifica los nucleones del núcleo atómico.
Cada átomo tiene diferentes propiedades químicas que dependen directamente del número atómico. Estos elementos se enumeran en una tabla periódica inventada por Mendeleyev y se denominan tabla periódica de elementos. El término reacción nuclear se refiere a la transformación de uno o más núcleos atómicos. Una reacción química, por otro lado, concierne únicamente a los electrones o los enlaces entre los átomos.
En una reacción nuclear, dos núcleos atómicos colisionan; Los productos resultantes de esta colisión son diferentes de las partículas originales. En el caso de la radiactividad, la transformación es espontánea, pero en el caso de una reacción nuclear, es producida por una partícula en movimiento. Si las partículas se separan después de la colisión sin transformarse, el proceso no es una reacción, sino una colisión elástica.
Entre los elementos radiactivos se encuentran:
- Polonio
- Ástato
- Radón
- Francio
- Radio
- Actinio
- Torio
- Protoactinio
- Uranio
- Neptunio
- Plutonio
- Americio
- Lawrencio
- Curio
- Berkelio
- Californio
- Einstenio
- Fermio
- Mendelevio
- Nobelio
Sus Usos
Los metales se han utilizado diariamente durante mucho tiempo. Forman una familia especial hecha de puntos comunes y diferencias entre sus miembros. ¿Cómo se diferencian los metales? Respuesta : Primero podemos usar la observación visual pero también otras técnicas más especializadas.
Las propiedades comunes de metales
- Conducción eléctrica: los metales son todos buenos conductores de electricidad y son casi los únicos materiales sólidos (por ejemplo, el grafito es un conductor no metálico). Esta es la mejor manera de diferenciarlos de otros materiales. Si el material es conductor, es muy probable que sea un metal.
- Conducción térmica: los metales conducen bien al calor.
- Brillo metálico: todos los metales brillan a la luz.
Los principales metales
- El oro es un metal casi inalterable (no se degrada fácilmente). Es amarillo brillante y bastante raro, de ahí su alto valor para los hombres durante mucho tiempo. Propiedades: metal precioso, baja resistencia mecánica, inalterable. Uso: joyería, electrónica (computadoras).
- La plata también es un metal precioso pero menos que el oro. Propiedades: muy buen conductor eléctrico, muy denso, baja resistencia mecánica. Uso: joyería, orfebrería, electrónica, fotografía.
- Propiedades del cobre, muy buen conductor eléctrico, fácilmente maleable, utilizado en aleaciones. Uso: cables eléctricos, fontanería.
- El hierro es el metal más conocido y más usado porque su precio es bastante bajo. De hecho, es fácil de encontrar y tiene propiedades muy interesantes para la industria. Desafortunadamente, el hierro tiene un defecto importante: se oxida en el aire , por lo que debe ser protegido (por otros materiales como la pintura) o utilizado como una aleación. Propiedades: bajo costo, propiedades mecánicas, se oxida al aire libre, atraído por un imán. Uso: varias construcciones.
- Propiedades del zinc solo se oxida en la superficie. Uso: construcción, automóvil, galvanizado.
- Propiedades del aluminio, solo óxido de superficie, peso ligero, buena resistencia mecánica. Uso: avión, construcción, embalaje.
Conductores
En general, los metales son eléctricamente conductores, siendo los mejores plata, cobre y oro, pero debido a su precio, la plata y el oro rara vez se utilizan como conductores de electricidad. Sin embargo, en computación y electrónica, el oro se utiliza, en capa delgada, para cubrir y proteger contra la corrosión de los conductores de cobre o los circuitos impresos de plata y sus conectores (lo que permite eliminar las resistencias de contacto que es encontrado en conectores y contactos en cobre oxidado).
El agua es un buen conductor en cuanto contiene algunas impurezas. Los materiales superconductores son excelentes conductores de electricidad tan pronto como se cumplen ciertas condiciones (por ejemplo, su temperatura) pero, debido a la infraestructura necesaria para su funcionamiento, solo se utilizan en casos específicos, como El acelerador de partículas CERN requiere campos magnéticos muy altos, pero también en los electroimanes de los dispositivos de MRI
Pesados
¡No es tan fácil definir los metales pesados! Su definición no se basa en la química sino en un concepto industrial. Como se dijo anteriormente, a menudo se definen como elementos metálicos que tienen una densidad superior a 5000 kg / m3 , pero este umbral a veces se reduce a 4000 kg / m3.
Según la definición histórica, solo hay tres metales pesados:
- mercurio
- plomo
- cadmio.
La clasificación periódica de los elementos también permite identificar como metales pesados todos los elementos entre el cobre (Cu) y el plomo (Pb). Finalmente, algunos los definen como todos los elementos metálicos del cuarto período de la tabla periódica.
Dada la toxicidad de ciertos compuestos, algunas sustancias tóxicas como el arsénico (de hecho, un metaloide) y ciertos compuestos organometálicos (como el metilmercurio) a veces se incluyen en la categoría de metales pesados.
Entonces, al final, ¿qué definición de metales pesados? Europa ha propuesto una definición utilizada para la Ley Europea y de los Estados miembros, un metal pesado se entiende cualquier compuesto de:
- antimonio
- arsénico
- cadmio
- cromo hexavalente
- cobre
- plomo
- mercurio
- níquel
- selenio
- teluro
- talio
- estaño
y otros materiales en forma metálica, siempre que estén clasificados como sustancias peligrosas.
Alcalinos
1. Litio
- Descripción: Blanco, plateado, metal suave. Reacciona lentamente con oxígeno y agua.
- Uso: Se utiliza en aleaciones (con Al y Mg), grasas, baterías, medicamentos y bombas nucleares.
- Etimología del nombre: Del griego lithos, piedra
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1817
- Descubridor (es): El científico o los científicos detrás del descubrimiento del elemento. Johan August Arfwedson. Suecia 1792-1841.
- Reglamento (GHS): SGH02 inflamable. SGH05 Corrosivo. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- Familia: Metales alcalinos.
- Estado químico: Sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- Masa: 6.94 g / mol.
2. Sodio
- Descripción: Suave metal blanco plateado. Se oxida rápidamente cuando se corta, reacciona violentamente con el agua.
- Uso: Producido en grandes cantidades y utilizado como metal en los intercambiadores de calor de reactores atómicos, el NaCl es un compuesto primordial de la industria química, utilizado para producir Cl2, NaOH.
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1807
- Descubridor (es). El científico o los científicos detrás del descubrimiento del elemento. Humphry Davy. Gran Bretaña. 1778-1829.
- Reglamento (GHS): SGH02 inflamable. SGH05 Corrosivo. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- Familia: Metales alcalinos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- Masa: 22.99 g / mol (Ver Articulo: Mar Mediterraneo)
3. Potasio
- Descripción: Metal blanco, suave, plateado cuando se corta. Reacciona rápidamente con oxígeno y violentamente con agua.
- Uso: Utilizado en fertilizantes, productos químicos y vidrios.
- Etimología del nombre: De latín kalium y árabe kali, álcali.
- Capas electronicas: 2, 8, 8, 1
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1807
- Descubridor (es) El científico o los científicos detrás del descubrimiento del elemento: Humphry Davy. Gran Bretaña. 1778 1829.
- Reglamento (GHS). SGH02 inflamable. SGH05 Corrosivo. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- Familia: Metales alcalinos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- Masa: 39.1 g / mol
4. Rubidio
- Descripción: Metal muy suave, de color blanco plateado y brillante cuando se corta. Se inflama en el aire y reacciona violentamente con el agua.
- Etimología del nombre: Del latín rubidio, rojo oscuro.
- uso: fibra óptica, equipos de visión nocturna.
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1861
- Descubridor (es) El científico o los científicos detrás del descubrimiento del elemento: Robert Wilhelm Bunsen. Alemania. 1811-1899 Y Gustav Kirchhoff. Alemania. 1824-1887.
- Reglamento (GHS). SGH02 inflamable. SGH05 Corrosivo. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH
- Familia: Metales alcalinos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- Masa: 85.47 g / mol.
5. Cesio
- Descripción: Metal suave, color dorado brillante. Reacciona rápidamente con oxígeno y explosivamente con agua.
- uso: Se utiliza para mejorar la catálisis en vidrios especiales y en dispositivos de control de radiación.
- Etimología del nombre: Del latín cesio, azul.
- descubrimiento: siglo 19
- Fecha de descubrimiento: 1860
- Descubridor (es): El científico o los científicos detrás del descubrimiento del elemento. Robert Wilhelm Bunsen. Alemania. 1811-1899 y Gustav Kirchhoff. Alemania. 1824-1887.
- Reglamento (GHS). SGH02 inflamable. SGH05 Corrosivo. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- familia: Metales alcalinos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- masa: 132.91 g / mol
6. Francio
- descripción: Altamente radiactivo. Elemento de larga duración.
- uso: No utilizado
- Representación simbólica de la distribución de electrones según las capas electrónicas del átomo. Las capas están en el siguiente orden, desde el núcleo: KLMNO PQ. La capa K tiene una capacidad de 2 electrones, la capa L tiene una capacidad de 8 electrones, la capa M tiene una capacidad de 18 electrones, las siguientes capas tienen una capacidad de 32 electrones.
- descubrimiento: siglo 20. Fecha de descubrimiento: 1939
- Reglamento (GHS) radioactivo. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- familia: Metales alcalinos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- masa: 223 g / mol
Oxidantes
Todos los metales sufren oxidación. Lo que caracteriza al óxido es que la oxidación debilita el soporte sobre el que se forma: las moléculas de óxido no se adhieren y la estructura se desmorona. Para otros metales como el zinc, el plomo o el cobre, la oxidación permanece unida al soporte.
La capa oxidada protege la estructura inferior aislándola del exterior. El plomo y el zinc se oxidan con una pátina gris clara (a menudo conocida como óxido blanco), mientras que el cobre pasa rápidamente de un color naranja no oxidado a un color verde característico (a menudo llamado óxido verde). El acero inoxidable contiene una cantidad significativa de cromo y níquel: la capa de óxido de cromo que se forma en la superficie limita el flujo de electrones de hierro si está en contacto con el agua y el agua. oxígeno.
Los constructores han comprendido esto durante mucho tiempo: no todos los metales son iguales ante la oxidación. Si el hierro es muy fácil de oxidar y frágil cuando se oxida, no es el caso del plomo, el zinc y el cobre lo que se puede admirar en muchos edificios antiguos o modernos. (Ver Articulo: Magnetismo)
De Transición
Los elementos de transición representan una gran fracción de la tabla periódica. Son esencialmente el bloque d. Sus metales y aleaciones poseen notables propiedades mecánicas, eléctricas y magnéticas utilizadas en la vida cotidiana (hierro, cobre, zinc ). Tienen una química extremadamente rica, múltiples grados de oxidación, muchos tipos de unión, complejos moleculares de estructuras altamente variables.
Son ampliamente utilizados por su reactividad en catálisis y como centros activos en química biológica (metaloproteínas). El hierro es entre ellos el más abundante y el más utilizado. De ahí nuestro mal título, cosas para hacer todo o casi todo. Aquí damos una breve descripción de los elementos y sus compuestos.
- escandio
- titanio
- vanadio
- cromo
- manganeso
- hierro
- cobalto
- níquel
- cobre
- zinc
- itrio
- circonio
- niobio
- molibdeno
- tecnecio
- rutenio
- rodio
- paladio
- plata
- cadmio
- lantano
- hafnio
- tantalio
- tungsteno
- renio
- osmio
- iridio
- platino
- oro
- mercurio
No Ferrosos
La categoría de metales no ferrosos está más diversificada que la de los metales ferrosos. Contiene principalmente aluminio, pero también cobre, plomo, níquel, zinc, estaño, cromo y muchos otros. Metales preciosos, como el oro y la plata, así como metales semipreciosos como el titanio, también se encuentran en esta familia.
Ya sea a partir de minerales metálicos o productos reciclados, los metales pasan por varios tratamientos mecánicos y químicos antes de convertirse en lingotes. El uso de metales no ferrosos reciclados, como el aluminio, en la fabricación de un nuevo producto tiene un impacto muy positivo en el medio ambiente. El consumo de energía se reducirá en un 95% en comparación con los materiales vírgenes, mientras que las emisiones de gases de efecto invernadero se reducirán en un 90%.
Metales no ferrosos
- acero inoxidable
- aluminio
- cobre
- latón
- plomo
Térreos
Los elementos que comprenden este grupo son:
- boro(B)
- aluminio(Al)
- galio (Ga)
- indio (In)
- talio(Tl)
- Nihonio (Nh)
Que forman iones con una carga triple positiva (3+), salvo el talio que lo hace con una carga monopositiva (1+). La característica del grupo es que los elementos tienen tres electrones en su capa más externa, por lo que suelen formar compuestos en los que presentan un estado de oxidación +3.
El talio difiere de los demás en que también es importante su estado de oxidación +1. Esta baja reactividad del par de electrones es conforme se baja en el grupo se presenta también en otros grupos, se denomina efecto del par inerte y se explica considerando que al bajar en el grupo las energías medias de enlace van disminuyendo.
Alcalinotérreos
1. Berilio
- descripción: Metal blanco, plateado, brillante, relativamente suave, inalterable en el aire o por el agua, incluso caliente al roce.
- uso: Asociado con el cobre y el níquel en algunas aleaciones, conduce a una excelente conductividad térmica y eléctrica. Se usa en televisores, calculadoras y computadoras.
- Representación simbólica de la distribución de electrones según las capas electrónicas del átomo. Las capas están en el siguiente orden, desde el núcleo: KLMNO PQ. La capa K tiene una capacidad de 2 electrones, la capa L tiene una capacidad de 8 electrones, la capa M tiene una capacidad de 18 electrones, las siguientes capas tienen una capacidad de 32 electrones.
- descubrimiento: siglo 18
- Fecha de descubrimiento: 1798
- Descubridor (es). El científico o los científicos detrás del descubrimiento del elemento: Louis-Nicolas Vauquelin. Francia. 1763-1829.
- Metales alcalinotérreos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- masa: 9.01 g / mol
2. Magnesio
- Descripción: Metal blanco plateado, relativamente suave. Se quema en el aire y reacciona con agua caliente.
- Uso: Se utiliza como en aleaciones ligeras para motores o como electrodo de sacrificio para proteger otros metales.
- Capas electronicas: 2, 8, 2
- Descubrimiento: siglo 18
- Fecha de descubrimiento: 1755
- Descubridor (s). El científico o los científicos detrás del descubrimiento del elemento: Joseph black. Gran Bretaña. 1728-1799.
- Reglamento (GHS). SGH02 inflamable. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- Familia: Metales alcalinotérreos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- estabilidad: 3 o más isótopos estables o casi estables
- Estable: el elemento tiene al menos un isótopo estable o casi estable.
- Radiactivo: el elemento no tiene un isótopo estable.
3. Calcio
- Descripción: Metal blanco plateado, relativamente suave. Protegido por una capa de óxido o una capa nitrogenada, se puede trabajar como un metal. Atacado por el oxígeno y el agua.
- uso: Utilizado en aleaciones y en la fabricación de Zr, Th, U y tierras raras. Gran uso como la cal (CaO).
- Capas electrónicas: 2, 8, 8, 2
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1808
- Descubridor (s). El científico o los científicos detrás del descubrimiento del elemento. Humphry Davy. Gran Bretaña. 1778-1829
- Reglamento (GHS). SGH02 inflamable. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- Familia: Metales alcalinotérreos.
- Estado quimico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- masa: 40.08 g / mol
- estabilidad: 3 o más isótopos estables o casi estables
- Estable: el elemento tiene al menos un isótopo estable o casi estable.
- Radiactivo: el elemento no tiene un isótopo estable.
4. Estroncio
- Descripción: Metal blanco plateado, suave. El metal está protegido por una capa de óxido pero se quema con el aire y reacciona con el agua.
- Uso: Se usa en lentes especiales para televisores y monitores, fuegos artificiales y bengalas de socorro para dar un tono rojo.
- Capas electrónicas: 2, 8, 18, 8, 2. Representación simbólica de la distribución de electrones según las capas electrónicas del átomo. Las capas están en el siguiente orden, desde el núcleo: KLMNO PQ. La capa K tiene una capacidad de 2 electrones, la capa L tiene una capacidad de 8 electrones, la capa M tiene una capacidad de 18 electrones, las siguientes capas tienen una capacidad de 32 electrones.
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1808
- Descubridor (s). El científico o los científicos detrás del descubrimiento del elemento. Humphry Davy. Gran Bretaña. 1778-1829.
- Familia. Metales alcalinotérreos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- Masa: 87.62 g / mol
- Origen: nucleosíntesis explosiva. El origen muestra la principal fuente de origen del elemento químico. Además de los diferentes tipos de nucleosíntesis (primordial, estelar, explosiva o espalación), el elemento puede derivarse de la desintegración de elementos más pesados y presente de forma natural en la tierra o, por el contrario, solo puede existir a partir de una síntesis artificial.
- Estabilidad: 3 o más isótopos estables o casi estables
- Estable: el elemento tiene al menos un isótopo estable o casi estable.
- Radiactivo: el elemento no tiene un isótopo estable.
5.Bario
- Descripción: Metal blanco plateado, relativamente suave. Atacado por el agua, el aire.
- Uso: Utilizado principalmente en forma BaSO4 en fluidos de perforación para prospección de petróleo o gas, pequeñas cantidades se utilizan en pinturas, vidrios.
- Capas electrónicas: 2, 8, 18, 18, 8, 2.
- Representación simbólica de la distribución de electrones según las capas electrónicas del átomo. Las capas están en el siguiente orden, desde el núcleo: KLMNO PQ. La capa K tiene una capacidad de 2 electrones, la capa L tiene una capacidad de 8 electrones, la capa M tiene una capacidad de 18 electrones, las siguientes capas tienen una capacidad de 32 electrones.
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1808
- Descubridor (s). El científico o los científicos detrás del descubrimiento del elemento. Humphry Davy. Gran Bretaña. 1778-1829.
- Reglamento (GHS). SGH02 inflamable. SGH07 Tóxico, irritante, sensibilizante, narcótico. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- Familia: Metales alcalinotérreos.
- Estado químico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- Masa: 137.33 g / mol
6. Radio
- Descripción: Un elemento radioactivo plateado, brillante y suave que se encuentra naturalmente en los minerales de uranio. Reacciona con oxígeno y agua.
- Uso: Fue utilizado en el tratamiento terapéutico del cáncer y para pinturas luminosas.
- Capas electrónicas: 2, 8, 18, 32, 18, 8, 2
- Representación simbólica de la distribución de electrones según las capas electrónicas del átomo. Las capas están en el siguiente orden, desde el núcleo: KLMNO PQ. La capa K tiene una capacidad de 2 electrones, la capa L tiene una capacidad de 8 electrones, la capa M tiene una capacidad de 18 electrones, las siguientes capas tienen una capacidad de 32 electrones.
- Descubrimiento: siglo 19
- Fecha de descubrimiento: 1898
- Reglamento (GHS): radioactivo. El Sistema Globalmente Armonizado (GHS) es un sistema internacional para el etiquetado de materiales peligrosos. Su objetivo es unificar los diferentes sistemas nacionales vigentes. El símbolo “Radiactivo” no está incluido en SGH.
- Familia: Metales alcalinotérreos
- Masa: 226.03 g / mol
- Estado quimico: sólido. El estado químico define el estado del material a una temperatura y presión dadas, en general, estas condiciones son iguales a las condiciones estándar.
- Origen: Producto natural de las caries. nucleosíntesis explosiva. El origen muestra la principal fuente de origen del elemento químico. Además de los diferentes tipos de nucleosíntesis (primordial, estelar, explosiva o espalación), el elemento puede derivarse de la desintegración de elementos más pesados y presente de forma natural en la tierra o, por el contrario, solo puede existir a partir de una síntesis artificial.
- Estabilidad: radioactivo
- Estable: el elemento tiene al menos un isótopo estable o casi estable.
- Radiactivo: el elemento no tiene un isótopo estable.
Líquidos
Para que un líquido sea capaz de se un conductor debe contener iones. Por lo tanto, una solución acuosa es conductora si un sólido iónico se ha disuelto en ella. El agua salada es, por ejemplo, conductora porque esta contiene iones de cloruro e iones de sodio.
El agua del grifo, así como las aguas de manantial y las aguas minerales también son conductoras porque las mismas contienen proporciones más o menos altas de minerales que se encuentran en forma iónica (iones de magnesio, ion, sodio, ion de calcio, ion de potasio, etc.).
En una solución acuosa, una corriente eléctrica produce el desplazamiento de los cationes hacia el terminal negativo, mientras que los aniones se dirigen hacia el terminal positivo.
Nobles
Un metal noble es aquel metal, que generalmente es muy capaz de soportar muchas formas de oxidación (resistencia al agua y al oxígeno) y corrosión (resistencia a los ácidos).
Sin embargo, dado que ninguno de los metales nobles puede soportar todas las formas de oxidación o corrosión, las soluciones ácidas, no existe un metal absolutamente o totalmente noble, sino solo metales con mayor o menor inercia química.
Estas propiedades son muy buscadas por los orfebres, la electrónica o la metalurgia porque son sectores para los cuales es esencial la inalterabilidad de un material. Asociadas con su mayor o menor rareza, estas propiedades confieren un gran valor comercial a estos metales. El término metal noble no es sinónimo de metal precioso
Lista de metales nobles
- oro
- plata
- platino
- iridio
- paladio
- rodio
- rutenio
- osmio
Dúctiles
La ductilidad es la propiedad específica de ciertos materiales, incluidos los metales, que describe su capacidad para soportar más o menos el estiramiento. Las pruebas en oro demuestran que es excepcionalmente dúctil: 1 gramo de oro produciría un cable de una longitud superior a 2000 metros y un grosor de solo 0.00001 mm.
Concretamente, un metal dúctil es un metal que puede soportar una importante deformación plástica sin que se rompa. Un metal se rompe cuando la deformación plástica que experimenta induce una grieta que se propaga y hace que se separe en dos o más piezas. Lo opuesto a la ductilidad es la fragilidad. Un metal que no soporta ninguna deformación plástica en absoluto, y por lo tanto tiene signos de resistencia, es particularmente frágil, ya que la ruptura ocurre inmediatamente.
Lista de los principales metales en orden de disminución de la ductilidad
- oro
- plata
- platino
- paladio
- hierro
- níquel
- cobre
- zinc
- aluminio
- estaño
Metales Más Ligeros
Su estructura de celosía, pero a nanoescala. En otras palabras, el nuevo material es 99.99% de aire y solo 0.1% de metal no especificado. Es el principio de la Torre Eiffel, dicen los científicos. Esta construcción, como algunos puentes, sigue siendo muy ligera a pesar de su tamaño. Hemos transpuesto este principio a la escala nanométrica y al micrón, resume el equipo estadounidense.
El 50% de los aceros que utilizamos hoy, cajas de sardinas para autos, no existían hace diez años”, dijo Yves Bienvenu, un experto y profesor de francés en Mines ParisTech. Los especialistas de hoy sueñan con aceros ultraligeros o transparentes, confirma. Los caminos preferidos para obtener el primero son casi la misma arquitectura que las nanotecnologías.
Si el material ultraligero desarrollado por los estadounidenses interesa la industria de la aviación, también se debe a que hay más acero en los aviones. Aparte del tren de aterrizaje o los ejes del motor, el titanio lo mordisquea todo. Pero los fabricantes de aviones siguen encariñados con las sustancias que aligeran su equipo.
Duros
Menos frágil que el diamante, más duro que el oro, más resistente que el titanio: es en iridio donde necesitas grabar tus recuerdos para la posteridad. Esta familia de platino no solo es extremadamente fuerte, sino que también es resistente a la corrosión.
Incluso el agua regia (una mezcla de ácido clorhídrico y ácido nítrico), que disuelve el oro y el platino, no tiene éxito. También es una de las sustancias más densas que existen: un cubo cuadrado de 10 cm pesa 22,4 kg / l. Solo el osmio lo hace mejor, con 22.5 kg / l.
Blandos
La superficie sólida para la fijación de los ligandos se compone de un soporte sólido de metal blando y un separador heterobifuncional clasificado química o físicamente al soporte sólido de metal blando a través de la unión de metal blando sobre una base blanda.
Este ensamblaje permite compensar la falta de resistencia mecánica de un metal blando como la plata pura, lo que permite aprovechar al máximo las excelentes propiedades electroacústicas de este metal, evitando los contactos defectuosos debidos a la deformación por fluencia de los metales blandos, etc.
La protuberancia de metal blando tiene una estructura compuesta que consta de al menos tres tipos de materiales para una parte superior, una parte lateral de la pared y una parte principal de metal blando. La invención concierne una película de recubrimiento duro que apenas se adhiere a un metal blando y es adecuada para recubrir, por ejemplo, la superficie de un molde de prensado en caliente que puede entrar en contacto con el metal blando.
Este segmento incluye capas de partículas de diamante y capas formadas por dos tipos diferentes de matrices metálicas en forma de placa, incluyendo matrices de metal blando y matrices de metal duro con ductilidad diferente. En comparación con los éteres de corona que contienen grupos de carboxilatos, los éteres de corona de diaza tienen una selectividad para los iones de metal blando en comparación con los iones de metal alcalino o alcalinotérreo.
Maleables
La maleabilidad es la propiedad de un material que se deforma en shock o presión en caliente o en frío, el mantenimiento de la nueva forma adquirida. La maleabilidad es la razón por la cual uno puede enrollar (enrollar) un material, forjarlo (martillar), o cortar más o menos fácilmente un material delgado.
El oro, la plata y el plomo son metales muy maleable y dúctil. La ductilidad es una propiedad condicionada por la maleabilidad. “La maleabilidad es la primera indicación de ductilidad; pero, sin embargo, solo nos da una noción bastante imperfecta del punto en el que la ductilidad puede extenderse.
Cromados
El cromo tiene la forma de un metal gris acero y duro. Su principal característica es resistir el deslustre y la corrosión. Se encuentran estados de oxidación de +2 a +6. El cromo hexavalente es particularmente oxidante, mientras que el cromo (II) es un agente reductor.
El uso más conocido del cromo es, sin duda, en la metalurgia, para dar una brillante interpretación además de mejorar la resistencia a la corrosión. El cromo también se usa como catalizador en algunas hidrogenaciones . Los cromatos, por sus variados colores (tonos de amarillo para el cromato de plomo ) se encuentran en las pinturas, pero son tóxicos. En los vasos , las sales de cromo añaden un toque de verde.
Galvanizados
La galvanización es la acción de una pieza de cubierta de una capa de zinc con el fin de proteger contra la corrosión . El tratamiento es anticorrosivo . La palabra proviene del nombre del inventor Luigi Galvani (1737-1798), un físico italiano que descubrió el galvanismo. En la industria, este término se refiere esencialmente a los procesos de “galvanizado en caliente”.
El galvanizado por inmersión en caliente , o más exactamente el “galvanización en caliente” es una técnica de la industria de la metalurgia que se utiliza para proteger contra la corrosión una pieza de acero con zinc. Este proceso confiere al revestimiento protector adherencia, impermeabilidad y resistencia mecánica. Una pieza tratada por galvanización se llama galvanizada.
Blancos
Las aleaciones de oro blanco (u oro gris) se han desarrollado para reemplazar las aleaciones de platino aún caras de la actualidad.
Incluso cuando se usa oro en la fabricación de joyas, hoy en día se utilizan métodos modernos de fusión y fundición.
Para la joyería, no solo el precio, sino también el color de la aleación juegan un papel, por lo que los desarrollos metalúrgicos dependen de la moda.
En los años 70, la moda estaba muy interesada en las aleaciones de oro blanco, independientemente de si cumplían con los requisitos del mercado. Hoy, es diferente. Las aleaciones desarrolladas por los centros de estudio evolucionan con las restricciones sobre el medio ambiente, la salud y, por supuesto, el precio.
Hay varias formas de lavar el oro:
- platino y paladio que dan al oro un color blanco brillante,
- Plata y zinc que le dan al oro un color blanco velado.
- Otros elementos como el manganeso, el cobalto, el rutenio o el indio, el germanio y el galio o estaño se pueden combinar bajo ciertas condiciones con oro para obtener un color blanco.
Halógenos
Los halógenos son los elementos químicos de la 17 º grupo (columna) de la tabla periódica , anteriormente grupo VII A: estos son los flúor 9 F, el cloro 17 Cl, el bromo 35 Br, el yodo 53 I, el astato 85 En y la tenencia 117 Ts. Estos dos últimos elementos son muy radiactivos, e incluso sintéticos para el último, solo los primeros cuatro están bien caracterizados y forman una Familia de elementos químicos homónimos con propiedades muy homogéneas: particularmente electronegativos, son químicamente muy reactivos, su reactividad disminuye cuando aumenta su número atómico
El flúor es, por lo tanto, el más reactivo de ellos, formando compuestos con todos los demás elementos químicos conocidos, excepto el helio y el neón. Astate pertenece al grupo de los halógenos, pero no a la familia de los halógenos, ya que está clasificado entre los metaloides.
En vista de sus propiedades físicas más metálicas que las del yodo; Astatine puede considerarse como perteneciente tanto a la familia de los halógenos como a los metaloides. En cuanto a la solemnidad, solo se ha producido a una tasa de unos pocos átomos con una vida útil muy corta (la vida media radiactiva de los isótopos 293 Ts y 294 Ts es del orden de 22 ms y 51 ms respectivamente). que sus propiedades físicas y químicas macroscópicas son desconocidas: por lo tanto, no se incluye en ninguna familia de elementos.
No Metales
A no metal es un elemento químico cuyo átomos de cuerpo simple están vinculados por enlaces covalentes o enlaces intermoleculares, y no por enlaces metálicos. Son buenos aislantes eléctricos y de calor, en su mayoría muy volátiles, caracterizado por una densidad de temperaturas más bajas y de cambio de estado generalmente mucho más bajos que los de los metales, con la notable excepción de carbono.
En la tabla periódica, los no metales están confinados en la esquina superior derecha, bordeados a su izquierda por los metaloides. 17 elementos generalmente se consideran no metálicos, de los cuales 11 son gaseosos (hidrógeno , helio , nitrógeno , oxígeno, flúor , neón , cloro , argón , criptón , xenón y radón) a temperatura y presión ambiente, 5 son sólidos (carbono , fósforo), azufre , selenioy yodo ), y 1 es líquido: bromo.
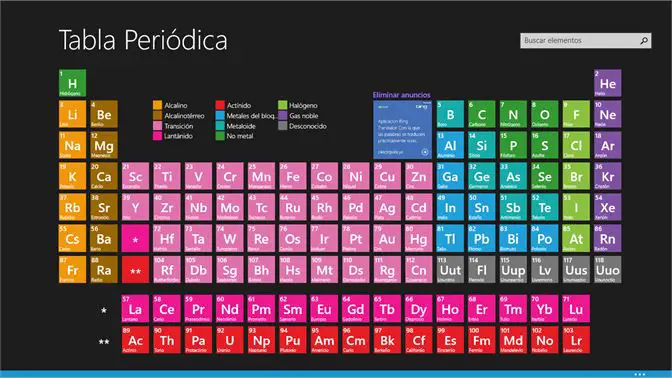
Tabla Periódica
La tabla periódica de los elementos, a veces llamada tabla de Mendeleyev o tabla periódica de elementos o simplemente tabla periódica, representa todos los elementos químicos que hemos encontrado (o supuestos para ciertos), clasificados por número atómico (a menudo llamado z) de de menor a mayor y organizados de acuerdo con su configuración electrónica y, por lo tanto, sus respectivas propiedades químicas.
El origen de la tabla periódica se atribuye generalmente al químico ruso Dmitri Mendeleyev que en 1869 configuró una mesa diferente a la utilizada hoy pero idéntica en su razonamiento. Mendeleev propuso clasificar sistemáticamente todos los elementos ya conocidos en su tiempo para resaltar la periodicidad de sus propiedades químicas, para poder identificar los elementos que quedaban por descubrir y también para deducir sus propiedades.
La mesa de Mendeleyev ha evolucionado a lo largo del tiempo, con un diseño que se conoce hoy en día y especialmente para el descubrimiento de nuevos elementos químicos, aunque para algunos, se suponía. La tabla periódica actual se ha convertido en un repositorio universal en el que podemos confiar para conocer los diferentes comportamientos físicos y químicos de estos elementos.
A menudo se encuentra la tabla periódica que se muestra en las aulas de la escuela, ya que los alumnos comienzan a estudiarla en los cursos de Física-Química en segunda clase. Esta tabla se encuentra en la forma más común para la clasificación de elementos químicos. Otros químicos (Theodor Benfey, Charles Janet, por ejemplo) han clasificado estos elementos de diferentes maneras, pero su uso sigue siendo bastante científico.
Aleaciones
Una aleación es la combinación de un elemento metálico con uno o más metales por fusión. Una de metal puro tiene características mecánicas que son en su mayoría relativamente pequeño tiempo. La adición de otros elementos permite “endurecer” el metal al aumentar sus características mecánicas.
Además de los refuerzos mecánicos generados por la deformación, como el endurecimiento , existen curas químicas al agregar elementos de solución sólida o por precipitación de fases secundarias de endurecimiento, como los carburos . Estas adiciones también permiten modificar las características químicas, como la resistencia a la corrosión, o mejorar otras características, por ejemplo, la fluidez.
En una aleación, el elemento metálico mayoritario, es decir, que constituye la parte más importante de la mezcla, se denomina “metal base” o “base”. Los elementos añadidos voluntariamente se denominan “elementos de aleación” o “elementos de adición” y los elementos no deseados se denominan “impurezas”.
Los elementos de aleación son a menudo metales, pero también pueden ser otros elementos químicos como el carbono en acero o hierro fundido , silicio en aluminio, etc.
Cuando el elemento de aleación no es un metal, su contenido es generalmente bajo (hasta un poco% en peso). Por lo tanto, en un acero la concentración de carbono es inferior al 2% en masa (menos del 7% en masa en el caso del hierro fundido), mientras que es posible fabricar una aleación de cobre – zinc (comúnmente llamada latón ) con un 50%. de cada uno de los elementos.
Ejemplos
- Aleación: Producto resultante de la mezcla de un metal con otros elementos metálicos o no.
- Acero: Hierro aleado con menos de 1.7% de carbono. Punto de fusión = 1400 ° C
- Acero inoxidable: acero que contiene cromo para resistir agentes corrosivos.
- Acero rápido: acero muy duro que contiene tungsteno, cromo, vanadio y molibdeno, utilizado para la fabricación de herramientas.
- Alpax: Aleación de aluminio y silicona que se moldea muy fácilmente.
- Amalgama: Aleación de mercurio con otro metal.
- Bronce: Aleación de cobre y estaño (4 a 22%). Históricamente, la edad de bronce es entre -2000 y -1000 aC
- Cupro-aluminio: Aleación de cobre y aluminio.
- Cuproníquel: aleación de cobre y níquel utilizada para la fabricación de monedas.
- Cupro-plomo: Aleación de cobre y plomo.
- Duraluminio: aleación ligera y resistente de aluminio, cobre y manganeso. Las alas de los aviones y los pistones de los motores de los automóviles son duraluminio.
- Hierro fundido: Aleación de hierro y carbono (1.7 a 6.67%) obtenida en altos hornos. La fundición gris (3,5 a 6% de carbono) es relativamente fácil de mecanizar; La fundición blanca (2,5 a 3,5% de carbono) se utiliza para la fabricación de hierro y acero.
- Invar: acero al níquel cuya expansión bajo la influencia del calor es muy débil.
- Nickel Silver: Aleación de cobre, zinc y níquel que imita a la plata.
- Permalloy: una aleación de níquel y hierro con una alta permeabilidad magnética (que está permeada por un flujo magnético).
- Zamac: es una aleación de zinc, aluminio, magnesio y, a veces, cobre. Es con las iniciales de estos metales que se formó el nombre zamac. Se utiliza principalmente en ingeniería mecánica, pero también en la industria del juguete porque tiene las mismas características que el plástico. Es fácil de trabajar y muy resistente.
- Zicral: Aleación de aluminio para equipos ligeros y pesados de escalada o aviación.
Hierro
Del metal gris, o mejor conocido como el hierro tiene varias formas alotrópicas, esto de acuerdo con la presión y la temperatura que posea ( cúbicas centradas, cen- tradas cúbicas centradas , compacto hexagonal). Este metal ferromagnético tiene una dureza entre 4 y 5 según la escala de Mohs. Se sabe que tiene tres óxidos: óxido de hierro (II) FeO (óxido ferroso), óxido de hierro (III) Fe 2 O 3 (óxido férrico) y óxido de hierro (II, III) Fe 3 O 4 .
Uso de hierro
El hierro no puro se puede utilizar, o generalmente es utilizado para la soldadura de acero inoxidable, por ejemplo. El hierro es el ingrediente principal y esencial en el acero y hierro fundido. Este contiene de 2.1% a 6.67% de carbono . El acero contiene 0.025% a 2.1% de carbono. Cuando tiene menos de 0.025% de carbono, los productos entran en la categoría de planchas industriales.
El hierro metálico y sus óxidos se han utilizado durante mucho tiempo en los medios de grabación de datos, como los disquetes o las cintas magnéticas.
Oro
El oro, designado en química por el símbolo Au , es un metal pesado, con una densidad de 19.5. Este es el elemento número 79 de la clasificación de Mendeleev. Es inalterable, inoxidable. Su peso atómico es 196 967 , su punto de fusión de 1064 ° C , el punto de ebullición de 2960 ° C . En condiciones naturales, se combina solo con mercurio. En condiciones particulares de temperatura y presión, se combina con algunos elementos raros (bromo, cloro, yodo en particular).
Es el metal más maleable y dúctil. Se trabaja en frío en forma de láminas cuyo grosor no puede exceder de una décima parte de un micro (es decir, diez milésimas de milímetro) o un hijo cuyo diámetro no exceda de una micra. Con un solo gramo de oro, puede hacer un cable de 3 km de largo o una hoja de un metro cuadrado de superficie.
Es resistente: su límite elástico es de 4 kilos por milímetro cuadrado y su carga de rotura de 13 kilogramos por milímetro cuadrado. Él se sienta fácilmente a sí mismo. Es un muy buen conductor de la electricidad y el calor. Se presta a aleaciones con otros metales (plata, cobre, níquel, platino, paladio, etc.).
Aluminio
- Composición: Extracto de minerales de los cuales el más usado es la bauxita (roca que contiene 45 a 60% de alúmina).
- Aspecto: Plata.
- Propiedades: Baja densidad. Leger. Particularmente maleable. Perfecto para aleaciones. Buena conductividad eléctrica y térmica. Resistencia a la corrosión. Baja resistencia mecánica. Reciclables.
- Puntos débiles: Hay alergias al aluminio.
- Oxidacion: El óxido de aluminio, llamado alúmina (revestimiento protector contra la corrosión y el aislamiento).
- Variaciones: Aleaciones de aluminio. A base de cobre, magnesio, zinc
- Campos de aplicación del bricolaje: Desde herramientas hasta piezas de construcción y marcos.
- Implementación: Fácil. Se puede limar o cortar (la oxidación para formar una nueva capa protectora es muy rápida).
Reciclables
Los metales, se pueden reciclar, y cabe destacar que esta acción contiene beneficios. Los beneficios del reciclaje de metales son muchos como por ejemplo: la reducción de la cantidad de residuos domésticos: el reciclaje da una segunda vida a los metales y evita que se almacenen en vertederos, o quemar en incineradores. Además, reducir la cantidad de residuos domésticos reduce el costo de su tratamiento. Ahorro de materias primas: ahorro de hierro al reciclar acero y ahorro de bauxita al reciclar aluminio. Ahorro de energía (hasta un 70% para el acero y hasta un 95% para el aluminio).
Listado de productos reciclables:
- tapa
- Lata de conservas
- Papel de aluminio
- Caja de metal
- instrumentos
- Estufa, cacerolas
- Latas de aerosol, latas
Reciclaje
El acero está separado del resto de los metales por un imán. Puede ser reciclado indefinidamente sin pérdida de calidad. O la chatarra se vuelve a fundir al 100% y luego se moldea para reutilizarla, o se agrega a la fundición de los altos hornos para obtener un nuevo acero.
Los metales no ferrosos, como el aluminio, se recuperan utilizando un separador de corrientes de Foucault y a mano. Luego se comprime con una empacadora. Las balas de 250 kg así formadas se confían a una empresa especializada que produce aleaciones secundarias de todas las formas de aluminio recuperadas.
Se puede Volver
- Aluminio: Fabricación de aleaciones para fundición. equipo automotor. mecánico. Chapa para la construcción. Fabricación de nuevos envases.
- Acero: Creación automotriz. embalaje. accesorios. muebles
https://www.youtube.com/watch?v=ywMHDY72Y1U
Detector de Metales
Como bien se sabe para obtener metales es necesario realizar ciertas búsquedas para dar con ellos, a continuación se hablará de los tres distintos modos de búsqueda:
- modo “todos los metales”: el detector busca todos los objetos compuestos ferrosos y no ferrosos (e incluso algunos minerales o meteoritos altamente mineralizados). Recordamos que este modo “todos los metales” es el modo más exitoso en el nivel de los descubrimientos, el dispositivo detecta todo lo que es metálico, entonces corremos el riesgo de perder el tiempo buscando nada, pero no debemos olvidar que es cavando que uno encuentra.
- “a discriminación” modo: discriminación permite la detección selectiva a través de la eliminación de todos los metales ferrosos durante la búsqueda (hierro, de acero, clavos, cápsulas). La entonces buscar los objetos metálicos no ferrosos ( Oro, cobre plata). Contrariamente a lo que uno podría pensar, la discriminación en un detector no es una garantía de poder descubrir todas las piezas preciosas, las pequeñas joyas pueden ser eliminadas por una discriminación demasiado alta (para referirse a la definición de “Discriminación” arriba en el léxico).
- el modo “muesca”: Función adicional a la discriminación para orientar la investigación hacia un solo tipo de metal y, en consecuencia, rechazar todos los demás metales que no sean los deseados (ejemplo: en una playa que desee encontrar piezas de 1 euro, memorice el Una moneda de 1 euro con la muesca que pasa debajo del disco, su detector ubicará las monedas de 1 euro y rechazará todo lo demás, incluso las monedas de oro). En conclusión, la muesca es interesante en el contexto de la investigación precisa.