El Modelo atómico de Rutherford fue la teoría que propuso que el átomo tenía un núcleo cargado positivamente y que los electrones, partículas de carga negativa se encontraban girando alrededor de ese núcleo. Este modelo propuesto por Rutherford, echo por tierra el modelo de J.J. Thompson. Si quieren conocer todo sobre el modelo atómico de Rutherford, lo invitamos a leer este interesante y completo artículo.
Indice De Contenidos
Historia del Modelo atómico de Rutherford
La historia de la teoría atómica se remonta al siglo VI antes de Cristo, como podemos notar la humanidad siempre desde tiempo remotos ha sentido inquietud por entender sobre la materia, la energía y su comportamiento.
Con respecto a los modelos atómicos estos han sido planteados desde la antigüedad, uno de las primeras propuestas fue realizada por Demócrito, quien era un filósofo griego que propuso que la materia estaba conformada por diminutas partículas, las cuales tenían como propiedad ser eternos, inmutables y que además eran indivisibles.
De esta propuesta surge la palabra átomo, la cual en griego antiguo significa “indivisible”. Leyendo la propuesta de Demócrito hoy en día, conociendo como en realidad funciona el modelo atómico, podemos estar verdaderamente sorprendidos de la similitud acertada de la misma. Sin embargo, para la época en que se realizó la propuesta del modelo atómico de Demócrito, esta no fue aceptada por los filósofos y estudiosos del momento.
Transcurrieron más de 2.000 años, para que esta idea de la existencia de átomos fuera nuevamente tomada en consideración. Durante el siglo XVIII y principios del XIX, la ciencia tenía una gran efervescencia y muchos científicos de todas partes de mundo se avocaban a investigar sobre los diferentes aspectos de las reacciones químicas, sobre la física y más. De ellos surgieron la diferentes leyes clásicas de ésta ciencia., como por ejemplo la Ley de conservación de masas, la Ley de las proporciones múltiples, entre otras.
En el año 1.808 John Dalton un científico inglés, hace pública su propuesta sobre el modelo atómico de la materia, estas sirvieron de fundamento para el desarrollo de lo que conocemos hoy en día como la química moderna. Dalton propuso, tal cual lo hizo Demócrito que la materia está formada por pequeñas partículas indivisibles llamadas átomos.
Que además había distintas clases de átomos que se diferenciaban por su masa y sus propiedades. Otra de las inferencias que dijo Dalton es que lo átomos que pertenecían a un mismo elemento poseen las mismas propiedades químicas, mientras que los que pertenecen a elementos distintos tienen propiedades diferentes.
Cuando se producen reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento determinado, desaparece y tampoco se transforma en un átomo de otro elemento. Con los aporte de Dalton se daba un paso enorme en el conocimiento del modelo atómico.
El aporte más relevante de Dalton fue la teoría en la que indica que la materia está compuesta por átomos de diferentes masas que se combinan para formar compuestos. Dalton llegó a su teoría atómica estudiando las propiedades físicas del aire atmosférico y de otros gases.
Luego en el año 1.897 Joseph John Thompson, quien era un científico británico, logró demostrar que lo átomos estaban cargados eléctricamente, las partículas diminutas por los que estaban conformados tenían cargas negativas y las llamó electrones.
De su descubrimiento J. J. Thompson propuso que el átomo era una esfera cargada positivamente y en su interior se encontraban incrustados los electrones, es por ello, que esta teoría del modelo atómico de Thompson, se conoce comúnmente con el pudin con pasas.
Como podemos observar antes de que Rutherford propusiera su modelo atómico, los científicos tenían coincidencia en sus propuestas y aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Basado en ese fundamento de distribuciones de cargas uniformes, Rutherford decide experimentar para conocer sobre la dispersión de las partículas alfa por parte de los átomos.
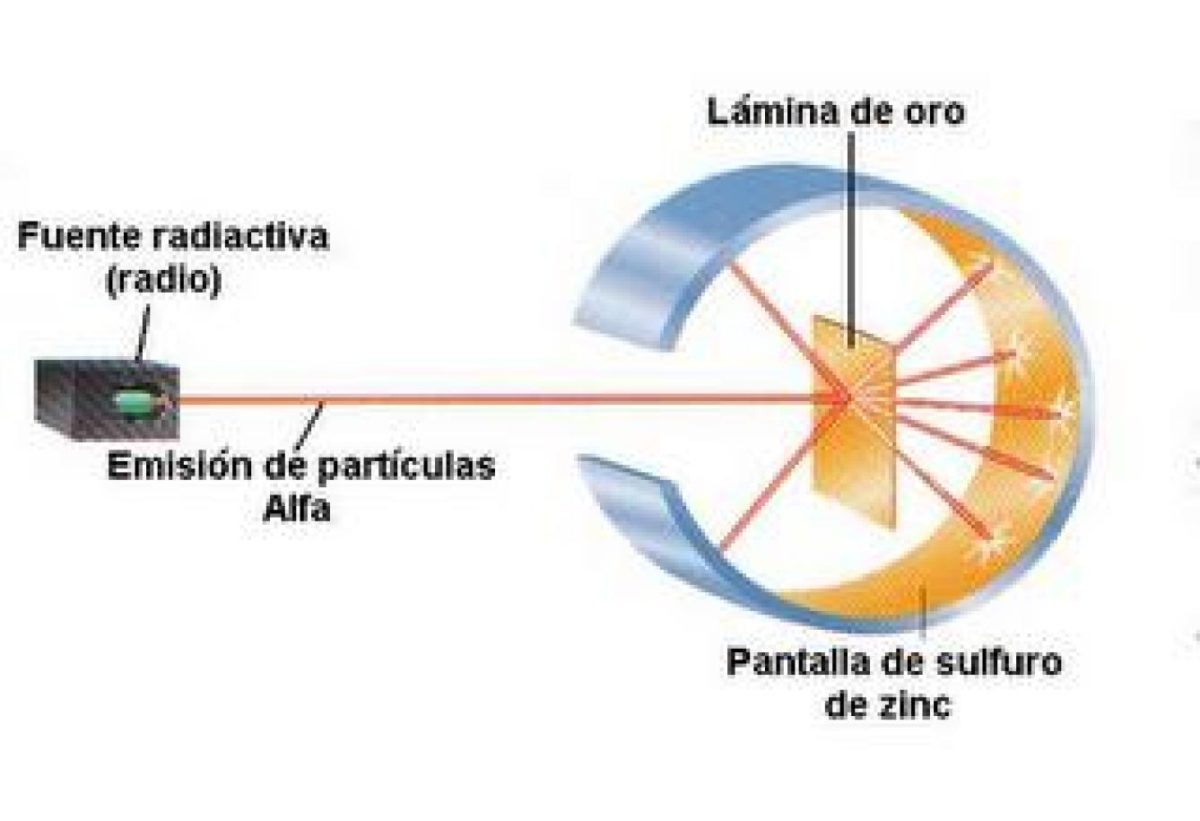
Apoyándose en sus ayudantes Hans Geiger y Ernest Marsden y bajo su supervisión, Rutherford realiza un estudio que se conoce como “el experimento de la hoja de oro”. Con este experimento se demostró que el modelo de “pudín con pasas” de Thomson, no era correcto y estaba equivocado, debido a que se demostró que el átomo tenía una estructura con una fuerte carga positiva.
En qué consistía este experimento de la Hoja de Oro, se trataba de bombardear con partículas alfa una delgada lámina de oro de 100 nanómetros de espesor. Las partículas alfa son átomos sin electrones por lo que solamente tenían protones y neutrones, recordemos que los protones son partículas subatómicas de carga positivas de un átomo, mientras que los neutrones son partículas subatómicas sin carga.
Por lo tanto, si el modelo de Thomson era correcto, las partículas alfa atravesarían los átomos de oro en línea recta. Para poder observar la dirección que tomaban las partículas alfa, colocaron un filtro de sulfuro de zinc alrededor de la fina lámina de oro.
En ese filtro se observó como algunas partículas atravesaban la lámina de oro en línea recta, pero otras eran desviadas en otras direcciones. Con este resultado Rutherford y sus ayudantes llegaron a la conclusión que las cargas positivas del átomo no se encontraban distribuidas en el átomo, sino que esta carga positiva se encontraba concentrada en el centro del átomo.
Si las cargas positivas estuviera distribuidas por todo el átomo, las partículas alfa pasarían en línea recta, ya que las cargas dispersas no serían lo suficientemente fuertes para cambiar la dirección de las partículas alfa. Pudo Rutherford concluir que la mayor parte del espacio de un átomo está vacío. Dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central que se encontraba cargado positivamente.
Importancia de este modelo
Los estudios y demostraciones realizadas por Rutherford sobre el modelo atómico fue un avance importante para la ciencia moderna. Al proponer y demostrar la existencia de un núcleo cargado de manera positiva en el átomo, permitió avanzar en el conocimiento del comportamiento de las partículas. El término núcleo fue también propuesto por Rutherford, después de publicar los resultados obtenidos con el experimento de la lámina de oro, Rutherford introdujo el término de núcleo.
Debido a que las partículas alfa con las que fue bombardeada la lámina de oro, provocaba que alguna de las partículas rebotarán y tomarán direcciones de hasta 180 grados, fue lo que Rutherford consideró era fundamental para considerar la existencia de una concentración de cargas en el centro del átomo.
Este fue un aporte de suma importancia para entender la materia, debido a que demostraba la existencia de un núcleo atómico en el que se concentraba toda la carga positiva y más del 99,9 % de la masa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío. Con base entonces en sus resultados, Rutherford propuso en su modelo atómico que los electrones daban vueltas alrededor del núcleo en el espacio vacío que lo rodeaba.
También con la propuesta del modelo atómico de Rutherford surgieron una serie de inquietudes, que fueron las que promovieron una serie de descubrimientos y teorías. Una de las primeras interrogantes que surgieron a raíz del modelo atómico de Rutherford, fue el ¿cómo se mantenían unidas las cargas positivas en el núcleo?.
Esta pregunta llevó a descubrir la fuerza nuclear fuerte. Otra de las inquietudes que surgieron del modelo propuesto por Rutherford, fue ¿cómo hacían los electrones para no perder energía y caer sobre el núcleo?. Con esta inquietud entraba en juego entonces los principios de la termodinámica, debido a que los científicos señalaban que si el electrón estaba orbitando alrededor del núcleo, estos producirían radiación electromagnética y perderían energía.
Surgieron entonces las leyes de Newton, conjuntamente con las ecuaciones de Maxwell para explicar el electromagnetismo aplicado al átomo de Rutherford, señalando que se trata de un modelo físicamente inestable.
Principios del modelo atómico de Rutherford
El modelo atómico de Rutherford se encuentra fundamentado en varios principios que indicaremos a continuación. El primero de ellos señala que las partículas que tienen carga positiva en el átomo se encuentran en un volumen muy pequeño, en comparación con el tamaño del átomo.
También el modelo atómico de Rutherford presume que la mayor parte de la masa que compone al átomo se encuentra precisamente en el núcleo del mismo. Otra de las premisas con las que debe cumplir el modelo atómico de Rutherford es que los electrones, que son las partículas subatómicas de carga negativa, giran alrededor del núcleo.
Otro de los principios que formula el modelo es que los átomos tienen órbitas y los electrones giran a altas velocidades alrededor describiendo éstas. Por último el modelo debe cumplir con el principio de que los electrones, los cuales tienen carga negativa y el núcleo con carga positiva, se encuentran unidos por fuerzas de atracción electrostática.
El experimento de la hoja de oro
A continuación vamos adentrarnos en el experimento que realizó Ernest Rutherford para concluir que el átomo está conformado por un núcleo cargado positivamente. Como señalamos anteriormente, el experimento es conocido como el “Experimento de la Lámina de Oro”, el mismo fue desarrollado en los laboratorios de física de la Universidad de Manchester, por lo ayudantes de Rutherford, llamados Hans Geiger y Ernest Marsden.
Como indicamos la importancia de este experimento no solo fue la propuesta de un nuevo modelo atómico, sino también todos los descubrimientos y teorías que surgieron a partir de él. El experimento consistía en bombardear una lámina súper delgada de oro con partículas alfa, la lámina de oro tenía un espesor de apenas 100 nanómetros.
La razón por la cual Rutherford y sus colaboradores seleccionaron este material, se debió a que es muy dúctil, por lo que permitía obtener una lámina muy delgada. La necesidad de que la lámina debía ser tan delgada, era evitar la interferencia por otro tipo de factores, que pudieran hacerse presente.
Las partículas alfa son iones que no tienen cargas negativas, es decir, son átomos conformados solo por protones y neutrones. Por lo tanto, esta era una manera de comprobar si el modelo de Thompson era correcto, ya que si las partículas alfa al traspasar la lámina de oro describían una trayectoria en línea recta, quería decir que realmente las cargas positivas se encontraban distribuidas por todo el átomo.
Para poder observar la posible desviación que sería provocada en las partículas alfa, fenómeno que en la física se conoce con el nombre de deflexión, Rutherford y su equipo, colocaron un filtro fluorescente de sulfuro de zinc, rodeando la lámina de oro. Al realizar el bombardeo de las partículas alfa contra la lámina de oro pudieron observar que algunas de las partículas alfa que atravesaban los átomos de oro, tenían una trayectoria en línea recta, pero otras eran desviadas.
Las desviaciones observadas en el filtro fluorescente de sulfuro de zinc, que rodeaba a la lámina de oro, mostraba que habían deflexiones de 180 grados. Esta fue la mayor de las pruebas para señalar que el modelo atómico propuesto por J. J Thompson estaba equivocado, ya que de encontrarse distribuidas las cargas positivas por todo el átomo, las partículas alfa viajarían sin sufrir este tipo de efecto rebote que habían logrado comprobar.
Limitaciones y errores
Rutherford y su equipo de trabajo habían realizado un aporte enorme a la ciencia con su propuesta de modelo atómico, en principio habían logrado demostrar que el modelo atómico de Thompson estaba equivocado, por lo tanto, las inferencias o teorías que se habían desarrollo con base en este modelo, estaban también equivocadas.
Por lo tanto, el nuevo modelo atómico de Rutherford, era un gran avance para la física, sin embargo, aún no era un modelo atómico perfecto. La primera limitación que se encuentra al modelo, surge con la inquietud de explicar, como los electrones se mantenían dando vueltas alrededor del núcleo, sin que su energía se agotará y cayeran sobre éste.
Esta era una de las limitaciones que presentaba el modelo atómico de Rutherford. Era por lo tanto, contradictoria a las leyes de la termodinámica. Maxwell elabora cuatro ecuaciones que relacionan los campos eléctricos y los campos magnéticos, con sus causas, es decir, con las cargas eléctricas, las corrientes eléctricas y los campos eléctricos y magnéticos variables.
Con las leyes de Maxwell se muestra como los campos magnéticos y los campos eléctricos se relacionan entre sí. Por lo tanto, cualquier variación del campo eléctrico generará un campo magnético y cualquier variación del campo magnético generará un campo eléctrico.
Estas variaciones de los campos eléctricos y magnéticos se propagan a través del espacio en forma de ondas electromagnéticas. Con base en ello, al considerar el modelo atómico de Rutherford que los electrones con carga negativa giraban alrededor del núcleo, en correspondencia con las leyes de Maxwell, estos deberían emitir radiación electromagnética.
Al emitir radiación electromagnética esta consumiría energía, lo que haría que los electrones colapsaran con el núcleo. Por lo tanto, el modelo no explicaba la estabilidad del átomo. Por lo que era un modelo inestable.
Otra de las limitaciones del modelo propuesto por Rutherford es que no se podía explicar cómo era posible que se mantuvieran unidas las partículas subatómicas que conformaban al núcleo, si todas tenían la misma carga. Como sabemos cargas iguales se repelen, por lo tanto, cómo era posible que las cargas positivas del núcleo se mantuvieran juntas.
Por lo que la explicación de cómo los electrones pueden describir órbitas estables alrededor del núcleo, cómo se mantienen unidos los protones en el núcleo y por qué los átomos presentaban espectros de emisión característicos y discretos son algunas de las interrogantes que el modelo atómico de Rutherford no puedo explicar de manera satisfactoria.
Si este artículo fue de su agrado y desea conocer más sobre temas interesantes, le invitamos a continuar su lectura a través de los siguientes enlaces que le recomendamos a continuación: