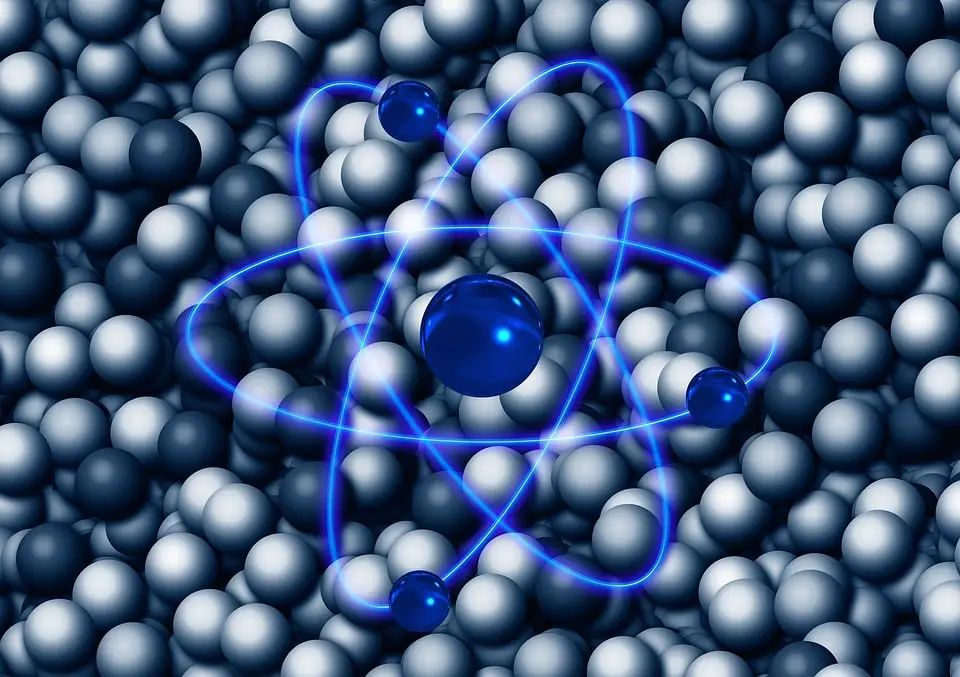
La partícula esencial más ligera que forma un átomo y tiene la menor carga posible en relación con la electricidad negativa se llama un electrón. Se trata de un elemento subatómico que rodea el núcleo, formado por neutrones y protones.
Indice De Contenidos
¿Qué es un Electrón?
La terminología nos indica que su significado en la física, el electrón, que normalmente está señalado en nuestra tabla periódica con la letra e, es una partícula subatómica con una carga eléctrica elemental negativa. Un electrón no tiene elementos o subestructuras conocidas. Es por ello que, podemos encontrar en los textos que se define como una partícula elemental. La teoría de cuerdas establece que un electrón está formado por una subestructura (cuerdas). Tiene una masa que es aproximadamente 1836 veces menos que el protón.
El momento angular intrínseco (spin) del electrón es un valor de medio entero en unidades de ħ, lo que significa que es un férmón. Su antipartícula es llamada postitron: es idéntica excepto por el hecho de que tiene cargas entre ellas, la eléctrica de signo opuesto. Cuando un electrón choca con un positrón, las dos partículas pueden ser totalmente aniquiladas y producir fotones de rayos gamma.
Los electrones, que pertenecen a la primera generación de la familia de partículas leptónicas, participan de interacciones fundamentales, como la gravedad, el electromagnetismo y la fuerza nuclear débil. Como toda la materia, tienen propiedades mecánicas cuánticas de partículas y ondas, de tal forma que pueden chocar con otras partículas y pueden ser difractadas como la luz.
Esta dualidad que se puede observar claramente, se demuestra mejor en experimentos con electrones debido a su masa muy pequeña. Dado que los electrones son fermiones, dos de ellos no pueden poseer los mismos estadios cuánticos, de acuerdo con el principio de exclusión de Pauli.
El concepto de una cantidad indivisible de carga eléctrica fue teorizado para explicar las propiedades químicas de los átomos. El primero en trabajar fue el filósofo naturalista británico Richard Laming en 1838. El nombre electrónico de esta escalera fue introducido en 1894 por el físico irlandés George Johnstone Stoney. Sin embargo, el electrón no fue identificado como una partícula hasta 1897 por Joseph John Thomson y su equipo de físicos británicos. (Ver Articulo: Polo Norte)
En muchos fenómenos físicos como la electricidad, el magnetismo o la conductividad térmica, los electrones tienen un papel muy importante. Un electrón cuando esta en movimiento genera un campo electromagnético y a su vez es redirigido por campos electromagnéticos que están localizados externamente. Cuando un electrón acelera, puede absorber o irradiar energía en forma de fotones. Los electrones, junto con los núcleos nucleares formados por protones y neutrones, forman los átomos.
Los electrones, sin embargo, contribuyen menos del 0.06% a la masa total de los átomos. La misma fuerza de Coulomb, que causa la atracción entre protones y electrones, también hace que los electrones estén conectados. La sustitución o división de los electrones entre dos o más átomos es la causa principal del enlace químico.
Los electrones pueden crearse mediante la descomposición beta de los isótopos radiactivos y en colisiones de alta energía, como la introducción de un haz cósmico en la atmósfera. Por otro lado, pueden destruirse mediante la destrucción con positrones, y pueden absorberse bajo la nucleosíntesis estelar. Hay instrumentos de laboratorio que pueden contener y observar electrones individuales, así como plasma de electrones.
Además, algunos telescopios pueden detectar plasma restos de los electrones en el espacio sideral. Los electrones tienen muchas aplicaciones, incluyendo electrónica, soldadura, tubos de rayos catódicos, microscopios electrónicos, radioterapia, láseres, detectores de desplazamiento y aceleradores de partículas.
Historia
Los antiguos griegos notaron que el ámbar atraía objetos pequeños cuando se frotaba contra la piel. Al igual que un rayo, este fenómeno es una de las primeras experiencias conocidas de personas con electricidad. En su disertación de 1600 De Magnete, el investigador inglés William Gilbert definió el término Neo-Latin “electricus” para referirse a la propiedad para atraer a otros pequeños después de frotar.
Ambas palabras tanto, eléctrica como electricidad, provienen del latín “electrum”, que a su vez proviene de la palabra griega “ήλεκτρον” (“Electrón”), que significa ámbar. A principios del siglo XVIII, Francis Hauksbee y Charles du Fay descubrieron cada uno de ellos, lo que pensaron que eran dos tipos de electricidad de fricción, una generada por la fricción con vidrio y la otra de fricción con resina.
A partir de esto, Du Fay teorizó que la electricidad consistía en dos fluidos eléctricos, “vitros” y “resinosos”, que se separaban por fricción y se neutralizaban entre sí cuando se combinaban. Una década más tarde, Benjamin Franklin sugirió que la electricidad no era de dos tipos diferentes de electricidad, sino con el mismo fluido a diferentes presiones; Se le da la nomenclatura moderna carga “positiva” y “negativa”, respectivamente.
Franklin creía que el transportista de carga era positivo, pero no identificó correctamente qué situación reflejaba un excedente en el transportista de carga y en cuyo caso era un déficit.
Entre 1836 y 1852, el científico y filósofo naturalista británico Richard Laming realizo aportaciones con la idea de que un átomo estaba compuesto por un núcleo de materia rodeado por elementos subatómicos y que este posee una carga eléctrica. A partir de 1846, el físico alemán Wilhelm Eduard Weber teorizó que la electricidad consistía en líquidos cargados positiva y negativamente, y su interacción se rige por la ley del cuadrado inverso.
Más tarde, después de estudiar el fenómeno de la electrólisis, el físico irlandés George Johnstone Stoney sugirió que había “una sola cantidad de electricidad”, la carga de un ión monovalente reactivo, para apreciar el valor de esta carga elemental bajo la ley de electrólisis de Faraday. Stoney, sin embargo, pensó que estas cargas estaban permanentemente vinculadas a los átomos y no podían eliminarse.
En 1881, el físico alemán Hermann von Helmholtz afirmó que las cargas positivas y negativas se dividían en partes elementales, cada una de las cuales se denominaba “átomos de electricidad”.
Teoría cuántica
En 1914, los numerosos estudios que fueron llevados a cabo, durante al menos 5 años consecutivos, hasta ahora por los físicos Ernest Rutherford, Henry Moseley, James Franck y Gustav Hertz habían establecido en gran medida la estructura del átomo como un núcleo denso rodeado de masas de electrones cargadas positivamente.
En 1913, el físico danés Niels Bohr postuló que los electrones vivían en países de energía cuantificada; Según él, esta energía estaba determinada por el momento angular de las rutas de electrones alrededor del núcleo. Los electrones pueden moverse entre estos estados o trayectorias emitiendo o absorbiendo fotones a frecuencias específicas. Usando estas vías cuantificadas, Bohr explicó las líneas espectrales del átomo de hidrógeno.
Sin embargo, el modelo de Bohr no motivó las intensidades relativas de las líneas espectrales y no pudo explicar los espectros para átomos más complejos. Los enlaces químicos entre los átomos explicados por Gilbert Newton Lewis en 1916 sugirieron que un enlace covalente entre dos átomos se mantiene mediante un par de electrones compartido entre ellos.
Más tarde, en 1923, Heitler y Fritz London dio una explicación completa sobre la formación de pares de electrones y las conexiones químicas en términos de mecánica cuántica. En 1919, el químico americano Irving Langmuir extendió el modelo estático de Lewis átomo y sugirió que todos los electrones fueron distribuidos en “capas esféricas sucesivas (casi) concéntricas, todos de espesor idéntico”.
Según Langmuir, estas capas se dividieron en varias células, cada una de las cuales contenía un par de electrones. Con este modelo, el científico estadounidense pudo explicar cualitativamente las propiedades químicas de todas las partes de la Tabla periódica, ya sabíamos cuáles eran similares de acuerdo con la Ley periódica formulada por Dmitry Mendeleev.
Mecánica cuántica
Después de su disertación en 1924 por Recherche sur la Theorie des Quanto, el físico francés Louis de Broglie sugirió la hipótesis de que toda la materia tiene una onda similar a la que se encuentra en la luz. Bajo condiciones apropiadas, los electrones y otros materiales exhibirían propiedades de partículas u ondas. (Ver Articulo: La Nieve)
Las propiedades de las partículas de ciertos elementos se hacen evidentes cuando se muestra que tiene una posición en el espacio a lo largo de su trayectoria en cualquier momento. Las ondas de luz se observan en la naturaleza, por ejemplo, cuando un haz de luz pasa a través de las ranuras paralelas y crea patrones de interferencia.
En 1927, el efecto de interferencia fue detallado por un haz de electrones del físico inglés George Paget Thomson con una delgada película de metal y por el físico estadounidense Clinton Davisson y Lester Germer con un cristal de níquel.
El éxito de la predicción de Brogly llevó a que Erwin Schrödinger publicara la ecuación de Schrödinger de 1926, que describe cómo se propagan las ondas de electrones. En lugar de proporcionar una solución que determina la ubicación de un electrón a lo largo del tiempo, esta ecuación de onda se puede usar para predecir la probabilidad de encontrar un electrón cerca de una posición.
Este enfoque fue llamado más tarde “mecánica cuántica”; Fue una aproximación extremadamente precisa de los estados de energía de un electrón en un átomo de hidrógeno. Al considerar el giro y la interacción de varios electrones, la mecánica cuántica predijo con éxito la configuración electrónica de los átomos con números atómicos más altos que el hidrógeno.
En 1928, el británico y suizo Paul Dirac pensó que el trabajo de Wolfgang Pauli era un modelo del electrón, la ecuación de Dirac, que era consistente con la teoría de la relatividad. Dirac aplicó consideraciones relativistas y simétricas a la formulación de Hamilton de la mecánica cuántica del campo electromagnético.
Para resolver algunos problemas en su ecuación relativista, Dirac desarrolló un modelo de vacío como un “océano” infinito de partículas de energía negativa, llamado el “mar de Dirac”. Todo esto hizo a Dirac capaz de predecir la presencia de positrón, la contraparte de la antimateria del electrón.
¿Qué carga tiene?
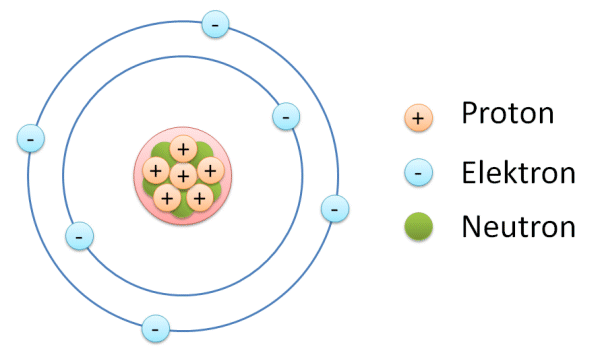
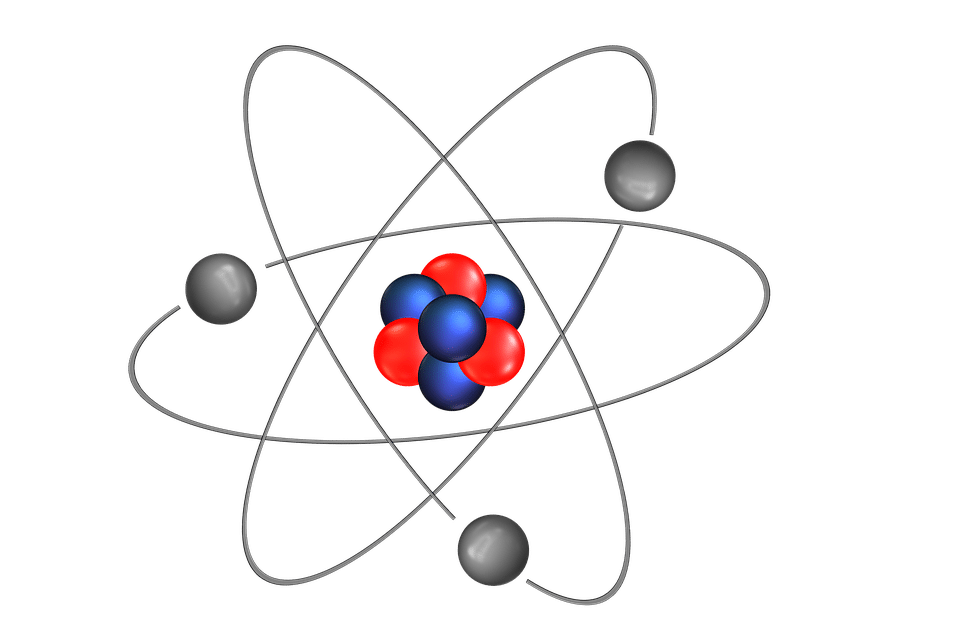
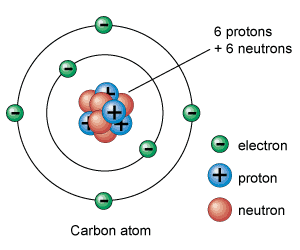
Los átomos consisten en un núcleo y una corteza (orbitador) En el núcleo, los protones y los neutrones están altamente unidos. Los protones tienen una carga positiva y los neutrones no poseen carga. Alrededor del núcleo se encuentran los caminos donde giran los electrones. Los electrones tienen una carga negativa.
Ambas cargas de los protones (positivo) y las de los electrones (negativo) son las mismas, aunque es el signo opuesto, para diferenciarlos entre sí.
En menor medida, la carga eléctrica elemental es la del electrón, siempre será de esta manera. El electrón es la partícula de un elemento, que relativamente lleva la carga eléctrica menos negativa que se puede aislar. Dado que la carga de un electrón lo cual es en consideración mucho mas pequeña, se toma en S.I. (Sistema internacional) para la unidad de carga eléctrica Coulomb correspondiente a 6,24 electrones 10E18.
Para designar la carga, se utiliza la letra Q y para su dispositivo, C. es C.
Ejemplo: Q = 5C
La masa y la carga de las partículas elementales se muestran en la tabla adjunta.
¿Cuál es su masa?
No es fácil hablar de “compresión” en el sentido clásico cuando se trata de partículas subatómicas. A menudo, para facilitar su comprensión, las partículas subatómicas, como las esferas y la mecánica clásica, se consideran cálculos que se realizan con ellas independientemente de la física involucrada en estos procesos que pertenecen a la esfera de la mecánica cuántica.
El electrón tiene una carga eléctrica de -1.6 x 10-19 C y una masa de 9.1 x 10-31 kg, que es aproximadamente 1800 veces menor que la masa del protón o neutrón a. El electrón es una partícula elemental (o al menos pensamos hoy), lo que significa que no tiene ninguna construcción. Por lo tanto, no tiene sentido hablar de compresión en algo que, por sí mismo, no tiene volumen.
Un caso más complicado son los neutrones y los protones. En un método extremadamente simplificado, generalmente se considera que los nucleones (protones y neutrones) están formados por tres cuartas partes llamadas quentores de quarks (dos quarks down y quarks en el caso de los neutrones, y dos quit y uno abajo para el protón).
Sin embargo, desde una perspectiva más profunda, más del 50% de la masa real de los nucleones de la energía de enlace debido a la fuerte interacción y los interminables quark y gluones ocurren constantemente y se desintegran en su interior. En general, las partículas formadas por los quarks están asociadas con la fuerte interacción conocida como hatrons.
La masa de protones y el neutrón son muy similares. En el caso de protones, es 1.6726 × 10-27 kg, mientras que en el caso de la masa de neutrones es 1.6749 × 10-27 kg. El neutrón es, por lo tanto, solo un 0,1% más grande que el protón.
Esta pequeña diferencia de masa es la clave para entender el universo tal como es ahora, con materia visible que consiste esencialmente en protones, y ser la clave de estos protones es estable o al menos tiene una vida media del orden o mayor que la edad del universo. Esto también significa que los núcleos no se disolverán y, como tal, existen, porque aunque el neutrón es inestable en los núcleos, no se destruye.
Una de las características de la interacción fuerte es que, a diferencia de otras interacciones conocidas (débil, electromagnética y gravimétrica), no debilitamos la distancia creciente.
Desde una cierta distancia (aproximadamente del mismo tamaño que un hadrón), la fuerza fuerte permanece en un valor constante de aproximadamente 10,000 newton, al menos a medida que el quark permanece alejado. Esto significa que para comprimir un protón debemos aplicar una fuerza que sea mayor que la fuerza fuerte y en este momento no conocemos ningún poder de estas propiedades en la naturaleza.
¿Quién lo descubrió?
El físico alemán Johann Wilhelm Hittorf realiza estudios de conductividad eléctrica en gases raros. En 1869 descubrió un resplandor emitido desde el cátodo que aumentó de tamaño cuando el gas cayó en presión. En 1876, el físico alemán Eugen Goldstein también mostró que la radiación en el brillo era una sombra, y los llamó “rayos catódicos”.
Durante la década de 1870, el químico y físico inglés Sir William Crookes desarrolló el primer tubo de rayos catódicos de alto vacío (vacío con una presión en el rango de 100 mPa a 100 nPa). Luego mostró que los brillantes rayos que aparecían en el interior del tubo transportaban energía y pasaron del cátodo al ánodo.
Al utilizar un campo magnético, Crookes también podía desviar los rayos, lo que mostraba que el haz parecía tener una carga negativa. En 1879, sugirió que estas características podrían explicarse por lo que él llamó “sustancia de radiación”.
Sugirió entonces que era el cuarto estado, que consiste en moléculas cargadas electro mecánicamente y negativamente proyectadas a alta velocidad desde el cátodo. El físico británico nacido en Alemania Arthur Schuster continuó los experimentos iniciados por Crookes colocando placas de metal en paralelo con las vigas de cátodo y aplicando un potencial eléctrico entre ellas. (Ver Articulo: Deshielo)
El campo desvió las vigas contra la placa cargada positivamente, lo que mostró aún más que las vigas tenían una carga negativa. Al medir la cantidad de desviación causada por una cierta corriente eléctrica, en 1890, Schuster pudo determinar la relación de masa a carga de los componentes del haz. Pero logró un valor que era más de mil veces el esperado, por lo que en ese momento no gastó mucho dinero en sus cálculos.
En 1896, el físico británico J.J. Thomson, junto con sus colegas y Harold John Sealy Townsend Albert Wilson, estuvieron a cargo de estudios que arrojaron que los rayos catódicos no son realmente partículas y ondas, átomos o moléculas, como se pensaba anteriormente. Thomson realizó buenas estimaciones tanto de carga como de masa, y descubrió que las partículas de rayos catódicos llamadas “células sanguíneas” podrían tener una milésima parte de la masa del ion hidrógeno menos masivo conocido.
De hecho lo mas importante lo demostró luego, que su relación carga / masa (e / m) que no dependía del material del cátodo. Más tarde, también pudo establecer que las partículas con carga negativa que eran producto del material radiactivo, a través de diversos elementos calentados y por materiales iluminados, eran universalmente. El nombre de ‘electrón’ para estas partículas fue nuevamente propuesto por el físico irlandés George Francis FitzGerald, y luego la palabra fue aceptada por delar.
En 1896, durante el período de estudio de los minerales naturales fluorescentes, el físico francés Henri Becquerel descubrió que emiten radiación sin exposición a ninguna fuente de energía externa. Estos materiales radioactivos se convirtieron en el tema de interés de estudio para muchos investigadores, incluido el físico Ernest Rutherford Zealander, quien descubrió que estaban liberando partículas.
Electrón diferencial
Otra de las derivaciones de los electrones diferenciales, son el último electrón que es agregado en la secuencia de la configuración electrónica de un átomo, y entonces se convierte en diferencial. ¿De donde surge la denominación de diferencial? Esta interrogante es fácil de responder, siempre y cuando debemos conocer muy bien la estructura básica de un átomo lo que es necesario: su núcleo, vacío y electrones.
Lo que sucede es que entonces el núcleo, se convierte directamente en un agregado compacto y rígido de partículas positivas llamadas protones, y de partículas neutrales denominadas sencillamente como neutrones. Los protones definen el número atómico Z y, junto con los neutrones, forman la masa atómica. Sin embargo, un átomo no puede llevar solo cargas positivas. Los electrones giran alrededor del núcleo para neutralizarlo.
Por lo tanto, para cada protón agregado al núcleo, es incorporado a un nuevo electrón en sus orbitales para contrarrestar el aumento de la carga positiva. De esta manera, el electrón de nueva aplicación, es por ende el electrón diferencial, que de hecho está estrechamente relacionado con el número atómico Z.
La diferencia electrónica está en la capa electrónica más externa: la capa de valencia. Por lo tanto, cuanto más lejos estés del núcleo, mayor será la energía asociada con él. Esta energía es la responsable de su participación, así como del resto de los electrones de valencia, en las reacciones químicas que son características de los elementos.
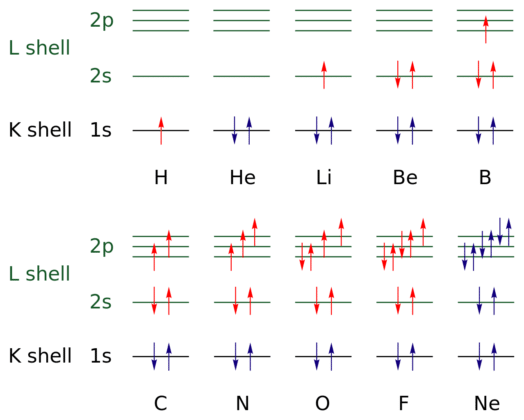
En la imagen de arriba, se representan las configuraciones electrónicas de los elementos de hidrógeno a neongas (H → Ne).
- En este caso, los electrones se indican en las capas abiertas con el color rojo, mientras que los de las capas cerradas se indican con el color azul. Las capas se refieren al número cuántico “n”, el primero de los cuatro.
- Por lo tanto, la configuración de la selección de H (↑ con color rojo) agrega otro electrón con la orientación opuesta para convertirse en el de He (↓ ↑, ambos azules, por ahora, el Nivel 1 está cerrado). Este electrón añadido es entonces el electrón diferencial.
- Por lo tanto, puede observar gráficamente cómo se agrega el electrón diferencial a la capa de valencia del elemento (flechas rojas), que los distingue entre sí. Los electrones llenan el orbital con respecto a la regla del hnu y el principio de exclusión de Pauling (plenamente observado de B a Ne).
¿Y qué pasa con los números cuánticos? Estos definen cada flecha, es decir, cada electrón, y sus valores pueden ser confirmados por la configuración electrónica para saber si son o no el electrón diferencial.
Configuración electrónica
En la materia como química, la configuración de un electrón nos indica científicamente y desde la perspectiva de la materia, cómo se estructuran, interactúan u organizan los electrones en un átomo según el modelo de capas electrónicas, donde los indicadores de onda del sistema en el cual vemos como esta relacionado como un producto subatómico o atómico de un orbital anti-simétrico. La configuración electrónica es importante porque determina las propiedades de la combinación química.
Desde otro punto de vista todos los átomos, varían de acuerdo a su posición en la tabla periódica del elemento. El arreglo de electrones en átomos está sujeto a las reglas de la mecánica cuántica. En particular, se da la configuración electrónica de una combinación de estados cuánticos, que es una solución de la ecuación de Schrödinger para ese átomo.
Una de las limitaciones de la mecánica cuántica no involucrada explícitamente en la ecuación de Schrödinger es que cada conjunto de electrones en los mismos estados cuánticos debe ajustarse al principio de exclusión de Pauli porque son fermiones (partículas semirrotacionales). Este principio significa que la función de onda total que describe este conjunto de electrones debe ser antisimétrica, por lo tanto, en el momento en que un estado cuántico esté ocupado por un electrón, el siguiente electrón debe ocupar otro estado cuántico.
Es por ello que según la mecánica cuántica, los electrones pueden pasar de un atómico a otro, ya sea entregando o absorbiendo una cantidad de energía, en forma de un fotón. Esta transición de una órbita a otra con diferentes energías explica diferentes fenómenos de emisión y absorción de radiación electromagnética de los átomos.
Origen de la configuración electrónica
Niels Bohr fue el primero en sugerir (1923) que la periodicidad en las propiedades de los elementos podría explicarse por la estructura electrónica del átomo. Su sugerencia se basó en el modelo atómico de Bohr para el átomo, donde las capas electrónicas eran vías electrónicas a distancias fijas del núcleo. Las configuraciones originales de Bohr parecen extrañas para el químico de hoy: al azufre se le asignó una configuración 2.4.4.6 en lugar de 1s2 2s2 2p6 3s2 3p4.
Un año después, EC Stoner incorpora el tercer número cuántico de la teoría de Sommerfeld en la descripción de las capas electrónicas, y prevé correctamente la estructura de las capas de azufre como 2.8.6.6 Sin embargo, ni el sistema de Bohr ni el de Stoner podrían describir correctamente los cambios del espectro atómico en un campo magnético (efecto Zeeman).