El átomo es parte esencial de lo que nos rodea, inclusive de nosotros mismos, a pesar de esto y de que se viene planteando la posibilidad de su existencia desde la antigua Grecia, solo desde hace unos 100 años es que se viene planteando como puede ser y se desarrollaron diversas teorías que fueron mejorando hasta llegar a lo que conocemos actualmente.
Indice De Contenidos
- 1 Historia
- 2 Etimología
- 3 ¿Qué es un átomo?
- 4 Tamaño de un átomo
- 5 Átomo gramo
- 6 ¿Cuáles son las partes de un átomo?
- 7 Dimensiones atómicas
- 8 Composición
- 9 Elementos
- 10 Tipos de átomo
- 11 Orbital atómico
- 12 Átomo neutro
- 13 Niveles de energía
- 14 Partículas subatómicas
- 15 Átomo cuántico
- 16 Isobaro
- 17 Isótopo
- 18 Ionizado
- 19 Radioactivo
- 20 Átomos estables e inestables
- 21 Átomo de carbono
- 22 Átomo de hidrógeno
- 23 Átomo de oxígeno
- 24 Átomo de nitrógeno
- 25 Átomo de cobre
- 26 Átomo de aluminio
- 27 Átomo de silicio
- 28 Átomo de hierro
- 29 Átomo de helio
- 30 Átomo de sodio
- 31 Átomo de litio
- 32 Átomo de cloro
- 33 Modelo atómico de John Dalton
- 34 Modelo atómico de Thomson
- 35 Modelo atómico de Rutherford
- 36 Modelo atómico de Bohr
- 37 Modelo atómico de Schrödinger
- 38 Modelo nuclear de Sommerfeld
- 39 Estado fundamental
- 40 Molécula
- 41 Diatómicos
- 42 Átomo del agua
- 43 ¿Se puede dividir?
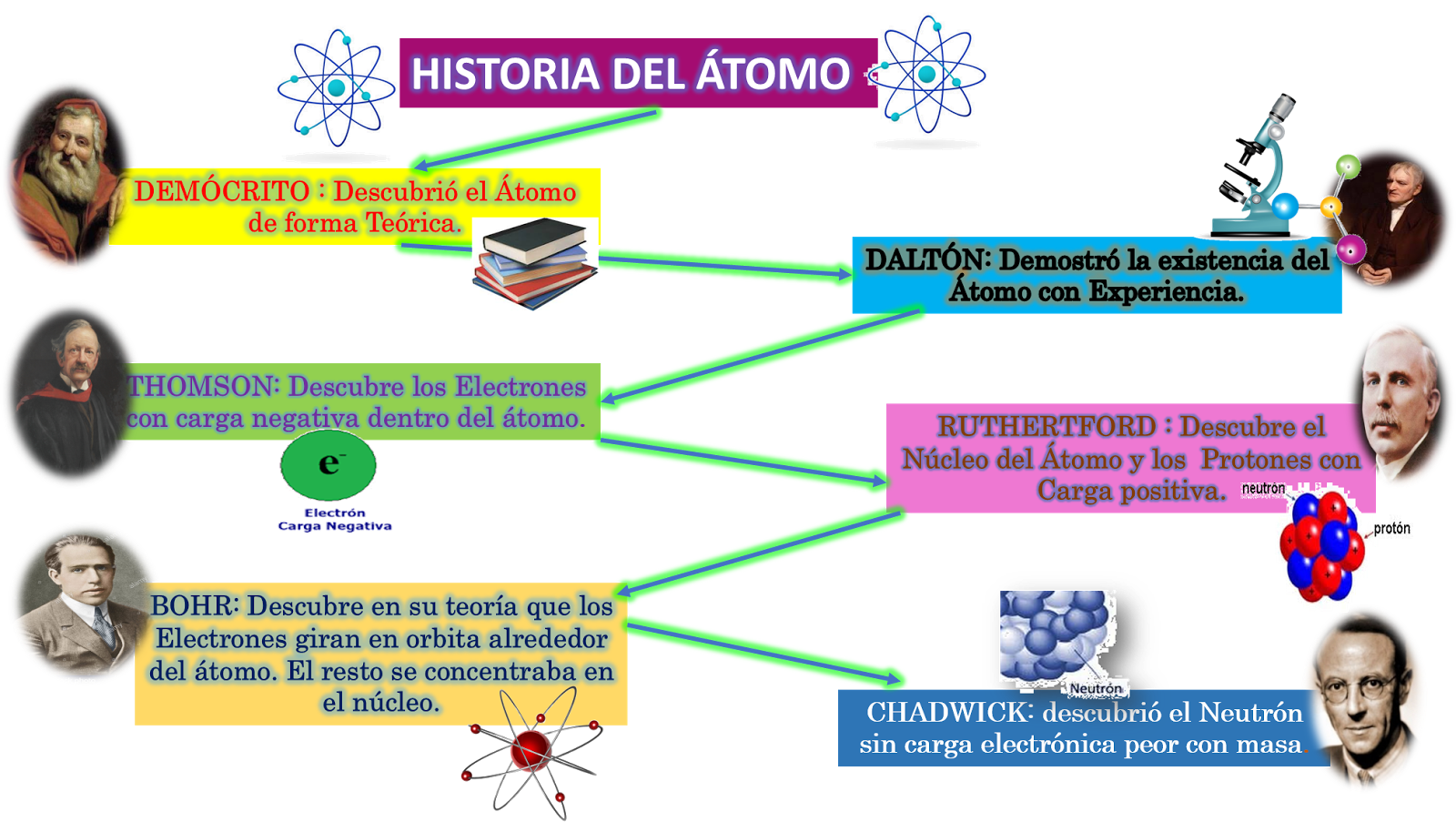
Historia
El átomo historia se da desde la antigua Grecia, propuesta por los racionalistas griegos Democritus, Leucippus y Epicurus, a pesar de que la idea no se produjo a través de la experimentación, sino más bien como una necesidad filosófica para aclarar la realidad, ya que, según lo propuesto por estos estudiosos, no se puede dividir indefinidamente la materia, por lo que debe haber un bloque o una unidad inquebrantable e indestructible que, al consolidarse de varias maneras, logre crear todos los cuerpos claramente visibles que nos rodean.
Estos conceptos son extremadamente legítimas, ya que la propiedad de la indestructibilidad y la indivisibilidad (que no se puede dividir) se convirtieron en los pilares clave de la química y la física actuales. (Ver Articulo Sobre: Centaurus).
El desarrollo crítico que lo acompañó no se realizó hasta que en 1773 el experto científico francés Antoine-Laurent de Lavoisier propuso que la materia no puede crearse o destruirse, simplemente cambia.
En ese momento, en 1811, el físico italiano Amedeo Avogadro, planteó la hipótesis de que a una temperatura, peso y volumen dados, un gas contiene de manera confiable un número similar de partículas, ya sean moléculas o’átomos, libremente de la naturaleza que tenga el gas, realizando al mismo tiempo la especulación de que los gases son moléculas poliatómicas con lo que se comenzó a reconocer las diferencias entre moléculas y átomos.
El experto científico ruso Dmítri Ivánovich Mendeléyev realizó en 1869 una caracterización de los componentes químicos según el orden ascendente de su masa atómica, comentando que había una periodicidad en las propiedades de la sustancia. Este trabajo fue el antecedente de la tabla periódica de los componentes, tal como lo conocemos hoy, por lo que hizo el átomo historia.
La perspectiva moderna de su estructura interna necesitaba mantenerse hasta el análisis de Rutherford en 1911. Este análisis llevó al modelo nuclear de Rutherford que no podía aclarar suficientemente la estabilidad de los átomos o los espectros atómicos, por lo que Niels Bohr planeó su modelo atómico de Bohr en Términos heurísticos, que representaban esas certezas sin aclararlas de manera útil.
Las revelaciones lógicas resultantes, por ejemplo, la hipótesis cuántica y los avances innovadores, como el microscopio electrónico, han logrado conocer con más detalle las propiedades físicas y compuestas de las partículas.
Etimología
En español utilizamos la palabra tomo para asignar una sección o división de un grupo de trabajos abstractos o un libro de referencia. A pesar de todo, tiene un significado único, dado que un tomo es una división o una pieza de una totalidad.
¿Qué es un átomo?
Un átomo es la unidad de emisión más pequeña que tiene las propiedades de un elemento de materia. Cada fluido, solido,gas y plasma está hecho de átomos neutros o ionizados. Los átomos son extremadamente pequeños; el tamaño del átomo básico es de alrededor de las 100 pm (diez mil millonésimas partes de metro). (Ver Articulo Sobre: Constelación Capricornio).
Sin embargo, los átomos no tienen límites característicos y existen diversos métodos para caracterizar el tamaño de un átomo que dan valores distintivos pero parecidos. Los átomos son lo suficientemente pequeños como para que la ciencia material tradicional dé resultados sorprendentemente inexactos. A través de la mejora de la física, los modelos nucleares han fusionado estándares cuánticos para clarificar y prever más fácilmente su conducta.
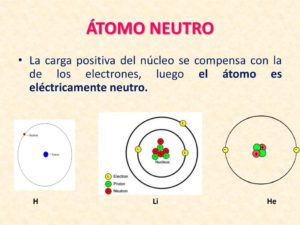
Los protones tienen una carga eléctrica positiva, los electrones tienen una carga eléctrica negativa y los neutrones tienen ambas cargas eléctricas, lo que los hace ser neutros. En el caso de que la cantidad de protones y electrones sea equivalente, esa molécula es eléctricamente neutra. En el caso de que una partícula tenga más o quizás menos electrones que protones, en ese punto tiene una carga positiva o negativa global, y se denomina ion (anión si es negativo y catión si es positivo).
Tamaño de un átomo
El interés por el tamaño del átomo y la masa del átomo atrajo a muchos investigadores a lo largo de un extenso periodo en el que la ausencia de instrumentos y sistemas apropiados impidió tener respuestas aceptables. Así, se desarrollaron varias pruebas rápidas que estaban destinadas a decidir el tamaño y el peso de los diversos átomos.
El tamaño de un átomo más liviana es el hidrógeno, tiene un ancho de aproximadamente 10-10 m (0.0000000001 m) yuna masa de alrededor de 1.7 x 10-27 kg (la porción de un kilogramo mencionada por 17 anticipado por 26 ceros y un punto decimal).
Cuando discutimos la medida de un átomo, vemos que estamos mirando algo extremadamente pequeño. De esta manera, en el caso de que veamos el diametro de una partícula, por ejemplo del átomo esta la del hidrógeno, veremos que su estimación en metros es insignificante hasta el punto de que apenas se puede estimar. Además, en caso de que discutamos la masa, es sustancialmente más escasa, tanto que apenas se puede calcular.
Con esto, a partir de ahora podrás imaginar cuán modesto es el universo de partículas, y mucho más, cuán poco será el interior de una molécula. Para darte un pensamiento, te proponemos que veas como ejemplo de átomo el sistema planetario solar y lo consideres un pequeño átomo: el Sol seria al núcleo de la partícula y los planetas, que giran a su alrededor, serán los electrones que se mueven alrededor del núcleo del átomo.
Según Angstrom: Unidad de longitud comparable a una separación equivalente a la centésima millonésima parte de un centímetro (0,000,000.01cm = 10-8cm, comunicada en documentación exponencial). Es el tamaño de un átomo ordinario.
¿De quién depende el tamaño de un átomo? El tamaño físico de un átomo es en realidad una especie de concepto difuso. La parte del átomo que se puede tocar es el electrón de valencia exterior. Electrones atómicos son muy tuvieron que precisar en la medida que no tienen una posición específica en el espacio.
Sabemos por el momento que la partícula de los electrones atómicos es bastante preciso basados en su nivel de energía por lo que su posición se unta a cabo en un orbital atómico o molecular.
En un gas monoatómico se repelen y dan lugar a la presión del gas, pero si apretamos lo suficiente los átomos ocupan menos espacio por lo que se hacen más pequeños. Esto es cierto en líquidos y sólidos, así que sólo se hace mucho más difícil de apretar con fuerza suficiente para medir el efecto sobre todo cuando el mecanismo se aprieta con está siendo comprimido tanto como la muestra.
Así que en un extremo tiene sólidos donde los átomos están íntimamente unidos y resistir compresión. Si sabemos lo que son los átomos en la muestra y lo que sus proporciones son que podemos buscar sus pesos en la tabla periódica y averiguar cuántos átomos se encuentran en un gramo o kilogramo utilizando el número de Avogadro.
Podemos entonces medir el volumen de que gramo o kilogramo masa y dividir volumen total por el número de átomos de conseguir volumen por átomo. En el otro extremo del espectro que tiene gases que se expanden para llenar el volumen que se los pone en lo que si se pone un átomo en un solo espacio centímetro cúbico el tamaño de ese átomo es un centímetro cúbico.
Los más átomos se ponen allí cuanto menor sea el espacio de cada uno toma y cuanto mayor sea la presión aumenta. Hay un límite práctico para el número de átomos de poder tocar en un espacio. En el interior del sol átomos de hidrógeno se presionan tan apretado que se fusionan para formar helio.
Finalmente, el hidrógeno puede utilizar y el calor de fusión se extinguirá y el sol se contraerá y, posiblemente, ser lo suficientemente densa para fusionar elementos más pesados. Con suficiente masa se pone el sol nova supernova y puede crear una estrella de neutrones que es un átomo gigante súper densa del tamaño de un planeta.
Continuando con nuestra pregunta, ¿De quién depende el tamaño de un átomo?, Así que el mensaje para llevar es que el tamaño del átomo depende del entorno del átomo es en desde cosas como la presión, temperatura y otros átomos pueden afectar drásticamente tamaño atómico.
Átomo gramo
¿Qué tal si analizamos el agua, enmarcada por dos átomos de hidrógeno además de una de oxígeno? En caso de que tuviéramos cuatro átomos de hidrógeno y dos átomos de oxígeno, podríamos enmarcar dos moléculas de agua; Con seis hidrógenos y cuatro oxígenos, obtendríamos tres de agua.
Manteniendo una proporción similar, podríamos elegir un número suficientemente grande para adquirir una medida de partículas o átomos que sea aparente y razonable. Esa es la razón por la que tenemos que caracterizar una unidad de medida correspondiente a la cantidad de partículas o átomos y que, por lo tanto, se puede relacionar con un tamaño cuantificable sin esfuerzo en el centro de investigación.
Por lo tanto, surgió la idea de utilizar ciertas cantidades en gramos para cada átomo o partícula, llamada átomo-gramo o molécula-gramo, por separado:
Una molécula-gramo es la medida de un compuesto, comunicada en gramos, que corresponde numéricamente con su masa molecular.
En el caso del agua: un átomo-gramo de oxígeno es equivalente a 15’999 g, dos de estos corresponde a 2’016 g, y una molécula-gramo de agua es 18’015 g, es decir, la totalidad de las cantidades anteriores sumadas.
Claramente, las cualidades de un átomo-gramo o una molécula-gramo cambian para cada componente o compuesto, sin embargo, tienen la posición favorable de poseer siempre un número similar de átomos o moléculas, por lo que hablan de cantidades que tienen relaciones similares uno con el otro, y son las mismas relaciones que tienen de los componentes y elementos a los que aluden (un átomo-gramo de oxígeno se une con dos átomo-gramo de hidrógeno en cada molécula-gramo de agua).
¿Cuáles son las partes de un átomo?
Desde entonces, los científicos han participado en un proceso de descubrimiento en curso con el átomo, con la esperanza de descubrir su verdadera naturaleza. En el siglo 20, se convirtió en nuestro entendimiento refinado hasta el punto de que hemos sido capaces de construir un modelo preciso de la misma. Y dentro de los últimos diez años, nuestro entendimiento ha avanzado aún más, hasta el punto que hemos llegado a confirmar la existencia de casi todas sus partes teorizado.
Estructura del átomo
La hipótesis reconocida hoy en día es que el átomo está hecho de un núcleo con carga positiva constituida por protones y neutrones, conocidos en conjunto como nucleones, alrededor de los cuales hay una nube de electrones cargados negativamente.
El núcleo atómico
El núcleo del átomo está formado por nucleones, que pueden ser de dos tipos:
Protón: Partícula de carga eléctrica positiva equivalente a una carga básica, y 1.67262 × 10-27 kg. Además, posee una masa 1837 veces más prominente que la del electrón.
Neutrón: Partículas que carecen de carga eléctrica y tienen una masa algo mayor que el protón (1.67493 × 10-27 kg).
El núcleo menos complicado es el del hidrógeno, formado solo por un protón. El núcleo del siguiente componente en la tabla ocasional, helio, está formado por dos protones y dos neutrones.
La cantidad de protones contenida en el núcleo del átomo se conoce como el número atomico, que se menciona en la letra Z y se establece en la parte inferior izquierda de la imagen de la sustancia. Este es el que ayuda a diferenciar un elemento de otro. Como se muestra, el número atomico de hidrógeno es 1 (1H), y el de helio, 2 (2He).
Del mismo modo, hay partículas que tienen el número atómico similar, sin embargo, los números másicos varían, que se conocen como isótopos. Por ejemplo del átomo, hay tres isótopos característicos de hidrógeno, protio (1H), deuterio (2H) y tritio (3H). Todas tienen las mismas propiedadesquímicas del hidrógeno y pueden estar separadas solo por ciertas propiedades físicas.
Los diferentes términos menos utilizados identificados con la estructura atómica son los isotones, que son átomos con un número similar de neutrones. Las isobaras son partículas que tienen un número de másico similar.Dado que los protones tienen cargas positivas, deberían rechazarse entre sí, aunque, el núcleo del átomo mantiene su unión debido a la presencia de otra potencia de mayor alcance, a pesar del hecho de que posee un menor alcance, esta se conoce como la interacción nuclear fuerte.
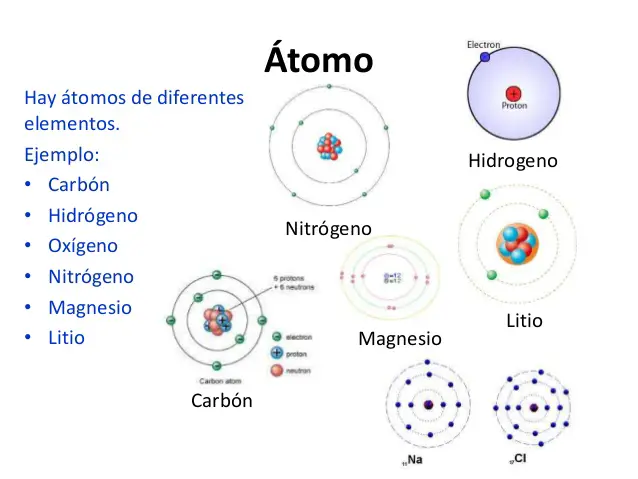
A continuación, veras imágenes de todos los átomos:
Cooperaciones eléctricas entre protones y electrones
Antes del experimento de Rutherford, los investigadores principales reconocieron el modelo nuclear de Thomson, una circunstancia que fluctuó después de la participación de Rutherford. Los modelos posteriores dependen de una estructura de átomos con una masa focal cargada positivamente y englobada por una oleada de carga negativa.
Estos tipos de átomo y su estructura impulsó a Rutherford a proponer su modelo en el que los electrones se moverían alrededor del núcleo en círculos. Este modelo tiene un problema originado por la forma en que una molécula cargada acelerada, como sería importante para lograr permanecer en su órbita, transmitiría radiación electromagnética, perdiendo energía.
Las leyes de Newton, junto con las educación de Maxwell conectadas al átomo de Rutherford, plantean que un período de orden 10^-10s, toda la energía del átomo se habría transmitido, con la caída resultante de electrones en el núcleo. (Ver Articulo Sobre: Evolución de las estrellas).
Corteza
A diferencia de los nucleones, un átomo puede perder u obtener una parte de sus electrones sin cambiar su identidad química, transformándose en solo un ion, una molécula con una carga neta única diferente a cero.
La idea de que los electrones están en círculos satelitales alrededor del núcleo se ha abandonado para tomar en cuenta una oleada o nube de electrones deslocalizados o difusos en el espacio, que habla mejor de la conducta de los electrones representada por la mecánica cuántica como elementos de densidad de probabilidad de encontrar un electrón en una zona finita de espacio entorno al núcleo.
Dimensiones atómicas
La mayoría de la masa de los átomos se acumula en el núcleo, formada por protones y neutrones, ambos conocidos como nucleones, que son 1836 y 1838 veces más pesados que el electrón por separado.
El tamaño o volumen correcto de un átomo es difícil de calcular, ya que las nubes compuestas de electrones no tienen bordes claros, aunque se puede evaluar sensiblemente en 1.0586 × 10-10 m, el doble del radio de Bohr para la partícula de hidrógeno.
Para propósitos de correlación, si un átomo fuera la medida de un estadio, el núcleo tendría las dimensiones de una canica colocada en el medio, y los electrones, similares a las partículas de residuos mezclados por la brisa alrededor de los asientos.
A continuación veras imágenes de todos los átomos que fueron premiados por el nobel:
Composición
Podemos considerar las partículas como un huevo donde el núcleo es la yema y la órbita alrededor del núcleo es la clara. En el caso de que pueda crear esta relación ahora, comenzaremos a revelar de que está hecha cada parte. El segmento focal del átomo (que es nuestra yema) se llama experimentalmente el núcleo de la partícula. Allí encontramos partículas más pequeñas que se llaman protones y neutrones. Los iniciales tienen carga positiva y los segundos no tienen carga.
Entonces, si los átomos son generalmente equivalentes en su estructura, no debería existir una variedad de materia, pero si sucede, esto se debe a que existen varias clases tipos del átomo de moléculas (particularmente 92). Lo que los separa es la cantidad de partículas subatómicas que tienen. Mientras tanto, su estructura atómica es diversa de su estructura electrónica: la cantidad y la circulación de los electrones. En este sentido, los átomos:
- Permanezca libre sin combinarse como los gases nobles (helio, argón) los cuales son moléculas monoatómicas.
- Se unen a diferentes átomos para enmarcar átomos biatómicos o triatómicos o macromoléculas que ensamblan un número más notable de moléculas. Estas partículas pueden estar hechas de moléculas equivalentes o diversas.
- Se pueden unir con diferentes átomos y hacen compuestos iónicos. Estos tienen un catión de carga positiva y un anión negativo que difieren en el agua.
- Incluso pueden ir junto con otros para crear un metal.
La variedad de atómicas crean sustancias distintivas: subatómicas, iónicas y metálicas, que son las que conforman nuestro universo y el planeta tierra. (Ver Articulo Sobre: Osa menor).
Elementos
Normalmente la materia está formada por átomos, los cuales a su vez están formados por protones, neutrones y electrones. El átomo se compone de un pequeño núcleo enmarcado por protones y neutrones, generalmente 20.000 veces más pequeños que el tamaño del átomo. La pieza externa del átomo se compone de varios electrones equivalentes a la cantidad de protones, lo que hace que el átomo en si sea eléctricamente neutro.
Se representa a los elementos mediante un símbolo químico, con el número atómico y el número másico en algunos casos incluido. El número másico es la totalidad de las cantidades de neutrones y protones en el núcleo.
Los componentes pueden ser reconocidos inequívocamente por las “huellas espectrales” de sus espectros de línea, y en ocasiones por las colores de la llama producido por los átomos excitados.
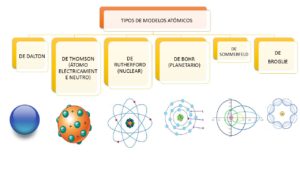
Tipos de átomo
El átomo es la unidad base que forma cualquier materia. Cada uno de estos tiene dos partes del átomo que son esenciales, en un lado están los protones (que tienen carga positiva) y en el otro los electrones (que tienen una carga negativa). Los átomos distintos pueden unirse, esta asociación se conoce como una molécula. Para comprender un poco más, una partícula de agua se compone de dos átomos de hidrógeno y un átomo de oxígeno en la denominación del compuesto sería H2O.
Aquí puedes ver imágenes de todos los átomos:
Cuando componemos un átomo en la denominación mencionada anteriormente, se escribe en mayúscula y el número que aparece debajo demuestra qué cantidad de átomos se requiere para dar forma a dicha partícula. Los tipos de átomos se pueden apreciar en los siguientes modelos:
- Modelo atómico de John Dalton.
- Modelo atómico de Thomson.
- Modelo atómico de Rutherford.
- Modelo atómico de Bohr.
- Modelo atómico de Schrödinger.
- Modelo atómico de Sommerfeld.
Orbital atómico
Un orbital atómico es aquella región del espacio caracterizado por una disposición específica, espacial y sin importar el tiempo, según la condición de la ecuación de Schrödinger para el caso de un electrón expuesto a un potencial coulombiano. La decisión de tres números cuánticos en la disposición general indica de forma unívocamente un estado monoelectrónico concebible. Estos tres números cuánticos aluden a la energía final del electrón, el momento angular orbital y a la proyección de este en el eje z de la estructura de laboratorio.
Átomo neutro
Aproximadamente el 99,94% de la masa de un átomo está en el núcleo. Los protones que lo componen tienen una carga eléctrica positiva, los electrones tienen una carga eléctrica negativa y finalmente los neutrones tienen ambas cargas eléctricas, haciendo a estos neutros. Si los protones y electrones están en cantidades iguales, ese átomo es eléctricamente neutro. Si un átomo tiene más o menos electrones que protones, entonces tiene una carga negativa o positiva, respectivamente, y se denomina a este ion (anión si es negativa y si es positiva).
Niveles de energía
En un átomo cualquiera, los electrones giran alrededor de las capas que enmarcan el núcleo. En cada uno de ellos, la energía que tiene el electrón es diversa. De hecho; en las capas cercanas al núcleo, el poder de atracción entre ellos y los electrones es excepcionalmente fuerte, por lo que estarán firmemente conectados.
Lo inverso se produce en las capas que se encuentran más alejadas, en las que los electrones están ligados de una forma muy débil, por lo que será más sencillo realizar transacciones electrónicas en las últimas capas. La realidad de que los electrones de un átomo tienen niveles de energía distintos, nos impulsa a agruparlos por el nivel de energía (o banda de energía) en el que se encuentra cada uno de ellos. Los grupos que más nos intrigan para comprender más fácilmente la conducta del átomo son:
La Banda de Valencia y la Banda de pilotaje
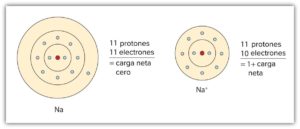
Como se puede apreciar, un átomo de sodio (Na) tiene 11 electrones, 2 en la capa principal, 8 en la segunda y 1 en la tercera, y Cloro (Cl) tiene 17 electrones, 2 en la inicial, 8 en la segunda y 7 en la tercera. Como todos los átomos suele tener en general 8 electrones en la última capa (regla del octeto): el sodio le dará 1 electrón al cloro, por lo que el primero tendrá 8 electrones en su última capa, así el cloro reconocerá que ese electrón, pasándolo a su última capa y en vez de 7 electrones pasara a tener 8.
Por lo tanto, el átomo de sodio que ha perdido un electrón se ha transformado en un ion positivo. Además, el cloro que ha agregado este electrón se convierte en una partícula negativa. (Ver Articulo Sobre: Continente europeo).
La banda de conducción es un nivel de energía en el que los electrones están considerablemente más separados del núcleo, de modo que, seguramente, cada uno de los electrones (que tienen un lugar con esa banda) son compartidos por cada uno de los átomos del ese sólido, y así puede moverse a través de este conformando una nube electrónica.
En el momento en que un electrón situado en la banda de valencia se le imparte de manera externa, la energía, ya sea eléctricamente, por la temperatura, la luz, etc. puede (al tiempo que adquiere energía) saltar a la banda de conducción, teniendo la capacidad de viajar a través del sólido.
Partículas subatómicas
Una partícula subatómica es aún más pequeña que el átomo. Muy bien puede ser una molécula básica o una molécula compuesta por otras partículas subatómicas, por ejemplo, los quarks que se componen de los protones y neutrones. Aunque, hay otras partículas subatómicas, que pueden ser compuestas como elementales, que no forman parte del átomo en si, como ocurre con los neutrinos y los bosones.
Estas partículas, tanto estables así como inestables, se crean sin rumbo fijo por la actividad de los rayos astronómicos mientras se estrellan contra los átomos que se encuentran en la atmosfera, y en los procedimientos que ocurren en acelerados de partículas desarrollados por el hombre, que reflejan un procedimiento como el primero, pero en condiciones controladas. En este sentido, se han encontrado muchas partículas subatómicas, y se estiman otras varias.
Un claro ejemplo de átomo de partículas teóricas sería el de la molécula hipotética son el gravitón; En cualquier caso, este y muchos otros no se han visto en los aceleradores de partículas desarrollados en la actualidad, ni en condiciones características en el medio ambiente (por la actividad de los rayos cósmicos). Como partículas subatómicas, las partículas virtuales también se clasifican, que son partículas que hablan de un paso de transición en el deterioro de una partícula que se encuentre inestable, y en consecuencia, duran muy poco tiempo.
Introducción a las partículas subatómicas
Fundamentalmente, se planteaba en los principales modelos nucleares tres tipos de partículas subatómicas: protones, electrones y neutrones. Posteriormente, la revelación de la estructura interior de protones y neutrones, descubrió que se trataba de partículas compuestas. Además, el tratamiento cuántico típico de las asociaciones entre las partículas deduce que la unión del atomo requiere otras partículas bosónicas, por ejemplo del átomo, piones, gluones o fotones.
Los protones se mantienen unidos por los neutrones por el impacto de los piones, que son mesones compuestos formados por conjuntos de quark y antiquark (así conectados por gluones). También hay otras partículas rudimentarias que están a cargo de los poderes electromagnéticos (fotones) y débil (neutrinos y bosones W y Z).
Los electrones, que están cargados de una carga negativa, tienen una masa de 1/1836 de la del conocido átomo de hidrógeno, todo lo que queda de su masa se origina del protón. El número atómico de un componente es la cantidad de protones (o la cantidad de electrones si el componente es considerado neutro).
Los neutrones, por otra parte, son partículas neutras con una masa fundamentalmente igual a la del protón. Los isótopos distintos de un componente similar contienen un número similar de protones pero un número diferente de neutrones. El número másico de un componente es el resultado de la suma de los protones y neutrones que tiene en su núcleo. Las propiedades más intrigantes de las tres partículas constituyentes estables de la materia existente en el universo son:
Protón: Se encuentra en el núcleo. Su masa es de 1.6 × 10-27 kg. Tiene un enfoque de carga positiva que posee la misma magnitud de la carga del electrón. El número atómico de un componente demuestra la cantidad de protones que tiene en el núcleo. Por ejemplo, el núcleo del átomo de hidrógeno contiene un protón solamente, por lo que su número nuclear (Z) es igual a 1.
Electrón: Se encuentra en la corteza. Su masa es de aproximadamente 9,1 × 10-31 kg. Tiene una carga eléctrica negativa (- 1.602 × 10-19 C) .1
Neutrón: Está en el núcleo. Su masa es casi equivalente a la del protón. No tiene una carga eléctrica.
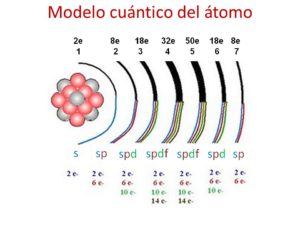
Átomo cuántico
El aprendizaje genuino y significativo es el de los átomos y el vacío, ya que son los que producen apariencias, lo que vemos, lo que es superficial, esto fue establecido por Democrito 2.400 años antes. Sea como fuere, el átomo comenzó a entender hace solo 100 años, cuando era el objeto principal de una de las mejores transformaciones científicas (la física cuántica).
Todo la materia que nos rodea está compuesto de átomos; nuestro cuerpo contiene el mismo número de átomos que la cantidad estrellas en el universo. Un siglo antes, los físicos enfrentaron la prueba de interpretar la pieza central que comprende la materia del universo.
Hacia el final del siglo XIX, los átomos comenzaron a dar algunos datos sobre su tendencia. Se vio que cuando un átomo recoge una gran cantidad de energía, irradia luz de ciertos tonos (frecuencias).
Thomson planteo el átomo como una masa de carga positiva que posee implantados sus electrones, como si fuera una torta de pasas. Junto con su grupo de trabajo, calculó si la vibración de las pasas podía aclarar la luz que era emitida por los átomos. Aunque, no tuvo éxito, por desgracia.
En poco tiempo, en 1911, Ernest Rutherford demostró que la masa de carga positiva del átomo está reunida en su interior, exactamente en el centro, motivo por el cual descubrió el núcleo del mismo. Realizo el modelo del átomo en la semejanza a un sistema planetario en el que los electrones son los planetas y el núcleo del Sol.
Aunque, ese planteamiento estaba en conflicto con una maravilla fundamental en la física: cuando la dirección de una molécula cargada (como el electrón) se dobla, pierde energía al transmitir la radiación. Parece como si el átomo se deslizara al girar y perdiera velocidad. Un cálculo básico demuestra que los electrones pierden toda su energía y, por lo tanto, la partícula debería desmoronarse o colapsar, en 0.00000001 segundos.
Aunque realmente no es así; la verdad es que los átomos que actualmente componen nuestro cuerpo son los mismos átomos que se formaron dentro de las estrellas una gran cantidad de años antes.
Planck propuso una solución frenética, pero extraordinariamente precisa: la radiación no se transmitía constantemente, sino a través de pequeños haces de energía, los conocidos cuantos de Planck. Además, en 1905, Albert Einstein utilizó este hallazgo para aclarar el impacto fotoeléctrico; fue su annus mirabilis en el que sorprendió al mundo de la física con su hipótesis de relatividad única.
Eran tiempos en que el océano de la ciencia era excepcionalmente revuelto; Parecía que los pilares centrales de la física habían caído. En estas circunstancias, hay dos tipos de físicos, los conservacionistas, que se sienten angustiados, y los transgresores que se miden contra las olas y necesitan que el océano no se calme. El físico danés Niels Bohr fue de los valientes.
En 1911 y con solo 26 años de edad, Bohr fue a Inglaterra a trabajar, primero con el equipo de Thomson y luego con Rutherford, quien recientemente había encontrado el núcleo del átomo. Bohr reflexionó: ¿cómo podríamos aclarar con la física que una partícula irradia luz en pequeños haces de energia?
En 1913, Bohr abordó esta investigación en tres artículos que retrataron su modelo del átomo. El primero contenía el pensamiento más transgresor: la energía de los electrones que giran alrededor del núcleo se da igualmente en haces o paquetes, es decir, se cuantifica. Con esta suposición, y dado que la energía del electrón se basa en la separación que posee con el núcleo, se deduce que el electrón solo puede circular en separaciones específicas, o niveles, del núcleo.
De esta manera básica, Bohr pudo aclarar un gran número de ensayos sobre la salida de luz de los átomos. No pareció importarle si los electrones giraban y perdían energía, básicamente propuso que esto no ocurriera en estas órbitas, ya que se mantuvieron estables por alguna razón desconocida. El modelo, independientemente de sus limitaciones, aclaró numerosas consecuencias de las líneas espectrales de los gases y la forma en que están ordenados los elementos en la tabla periódica.
Hoy nos damos cuenta de que el átomo de Bohr es excesivamente básico, sin embargo presenta aspectos destacados de la física atómica. A pesar del hecho de que, al analizar el mundo cuántico, uno debe ser consciente y muy precavido, en el relación al átomo, es más correcto visualizar los electrones, no como partículas, sino como nubes difusas alrededor del núcleo, cuyo grosor en cada punto habla de la probabilidad de encontrar el electrón en ese sitio.
Bohr fue un investigador significativo que reunió a los mejores físicos cuánticos en su organización. Bien conocidos fueron sus discursos con Einstein sobre la elucidación de la ciencia material cuántica. En conflicto con él, Bohr confió en que la naturaleza, en su articulación más íntima, es indeterminada, o sea, que juega a los dados, y en esto tuvo razón.
Un siglo atrás, la física cuántica estableció otra visión del mundo y la información del átomo fue un cambio progresivo en la historia lógica y mecánica del mundo. En la actualidad, la física cuántica es un activo excepcional para progresar significativamente más en las nuevas tecnologías: desde la construcción de relojes nucleares ultra exactos o la codificación de datos extremadamente delicados en un camino completamente protegido, hasta el avance lejano, aunque alcanzable, del PC cuántico equipado para cálculos que son difíciles de imaginar en la actualidad.
Isobaro
Se llaman isóbaros (del griego: ἴσος, isos = igual; βαρύς, barýs = sustancial) a los diversos núcleos atómicos con un número similar de masa (A), pero con un número atómico único (Z). Las cualidades químicas son únicas (a diferencia de los isótopos), la cantidad de protones y la cantidad de electrones contrastan:
40Ca, 40Ar
Isótopo
Isótopo se le llama a los átomos que son de un mismo elemento, cuyos núcleos tienen una medida distinta de neutrones, y de esta manera, varían en su número másico.
La palabra isótopo (del griego: ἴσος isos ‘equivalente, igual’; τόποςópospospos ‘,’ en un lugar similar “) se utiliza para demostrar que una amplia gama de átomos de un elemento químico similar (isótopos) se encuentran en una puesto similar en la tabla periódica.
Gran parte de los elementos químicos tienen más de un isótopo. Solo 8 elementos (por ejemplo, berilio o sodio) tienen un isótopo natural. Por el contrario, el estaño es el componente con isótopos más constantes, ya que posee un total de 10. Diferentes componentes tienen isótopos naturales pero inestables, por ejemplo, uranio, cuyos isótopos pueden cambiar o caer en otros isótopos más estables, transmitiendo radiación todo el tiempo, por lo que se dice que son radioactivos.
Los isótopos no estables son valiosos para evaluar la edad de una amplia variedad de muestras naturales, por ejemplo, las rocas y la materia orgánica. Esto es concebible, siempre y cuando se conozca la tasa normal de descomposición de un isótopo específico, en relación con aquellos que ya han decaído. Gracias a esta estrategia de datación, la edad de la Tierra se puede estimar.
Ionizado
La ionización se describe como el fenómeno físico o químico a través de la cual se crean los iones, los cuales son átomos o moléculas cargadas eléctricamente debido a la abundancia o ausencia de electrones en cuanto a un átomo o molécula neutra. La especie química con un número mayor de electrones que el átomo o molécula neutra se le denomina anión, el cual tiene una carga neta negativa y aquella que tiene menos electrones se le denomina catión, con una carga neta positiva. Hay algunas formas diferentes por las que se pueden crear iones de moléculas o átomos.
Radioactivo
Hemos visto que algunos componentes son radiactivos, mientras que otros definitivamente no lo son. Esto sugiere que la radiactividad se produce a un nivel atómico, por lo que necesita mirar los átomos, particularmente los núcleos, para comprenderlo mejor.
Para entender esto se debe profundizar mucho más en el tema, pero por el momento supongamos que se debe a la cantidad diversa de nucleones en el núcleo, y específicamente a la proporción entre protones y neutrones. Se emiten tipos del átomo distintivos de radiación para varios tipos de inestabilidad. Esa es la razón por la cual diversas fuentes emanan radiación distinta.
La inestabilidad no está limitada a núcleos específicos. Los neutrones se descomponen e incluso los protones terminan desintegrándose, pero solo sucede después de un período de aproximadamente 10^34 años. Entonces, en el tiempo que tiene la vida humana en la tierra, los protones se deben considerar como constantes.
Átomos estables e inestables
Se conoce como un átomo estable a la que tiene su última orbita completa de electrones o, si no, que al menos posea ocho electrones en ella. Por otro lado, los átomos inestables son aquellas que no han llenado su órbita de valencia y tampoco posee ocho electrones en esta, tienen una inclinación increíble para convertirse a átomos estables, ya sea deshaciéndose de los electrones de valencia o absorbiendo electrones libres desde el exterior hasta lograr completar su última orbita. Para cada situación harán lo que menos energía necesite.
Átomo de carbono
La vida en nuestro planeta es concebible debido a dos maravillas que establecen una irregularidad en el ámbito de la química: el puente del hidrógeno y la catenación del carbono. En referencia al átomo de agua, H2O, el puente de hidrógeno es un poder de atracción que ocurre entre el hidrógeno de una molécula y el oxígeno de otra molécula.
Desde otro punto de vista, la catenación es el límite de un componente para crear cadenas; Es decir, unirse químicamente consigo mismo. No solo el elemento carbono tiene este límite, sin embargo, es el que generalmente lo hace con más frecuencia, y en las formas más cambiadas. (Ver Articulo Sobre: Cuencas Hidrográficas).
El símbolo que representa al átomo del carbono es “C”. En el dialecto español, “carbono” no es equivalente a “carbón”. “Carbono” es el nombre del componente, y “carbón” es un sólido que principalmente está formado por cadenas de átomos de carbono. El carbono encontrado en la Tierra se generó hace aproximadamente 5000 millones de años, en medio del tiempo de desarrollo del sistema solar, en el que se desarrolló mucho la química de fusión nuclear, y parecía ser moderadamente estable.
Esto le permitió aportar una suma que habla del 0,02% en peso del considerable número de componentes. A pesar de que esta tasa parece ser baja, el carbono es el duodécimo componente más abundante de nuestro planeta.
El carbono tiene un lugar exactamente en el grupo 14 de la tabla periodica, cuyos componentes son: carbono (C), silicio (Si), germanio (Ge), estaño (Sb) y plomo (Pb). Los tres iniciales son no metales, y los dos últimos son metales. Cada uno de estos componentes comparte el límite de catenación, pero ninguno de ellos lo hace tan fácilmente como el carbono.
A parte de la conexión o concatenación, el carbono puede actuar como tal a través de un enlazado múltiple, lo que implica conectarse entre sí mediante enlaces dobles y triples. Esta última propiedad es regular al nitrógeno y al oxígeno, sin embargo, en tales casos, la catenación es moderadamente poco común.
Esta característica específica es lo que permite que exista una gran cantidad de mezclas de carbono. La cantidad de mezclas que contienen carbono es mucho veces más prominente que la cantidad de sustancias que no lo contienen.
Átomo de hidrógeno
El átomo de hidrógeno es el más simple que existe y el único que concede una solución lógica exacta desde la perspectiva de la mecánica cuántica. El átomo del hidrógeno, se denomina también como átomo monoelectrónico, ya que está formado por un protón que se encuentra en el núcleo de la partícula y que contiene más del 99.945% de la masa del átomo, y un solo electrón, unas 1836 veces menos enorme que el protón que “gira” alrededor de dicho núcleo (a pesar de que los átomos de hidrógeno también pueden existir con núcleos enmarcados por un protón y 1 o 2 neutrones más, llamados deuterio y tritio, por separado).
Se podría hacer una analogía instructiva del átomo de hidrógeno con nuestro sistema planetario, donde el Sol sería el núcleo atómico único y que tiene la mayor medida de masa, exactamente el 99.86% del sistema, y en su órbita tenía un solo planeta (Electrón) que conformaría lo que queda de la masa del Sistema (átomo de protio (1H)). Esto hace que el hidrógeno sea el más sencillo del considerable número de elementos de la tabla periódica.
Átomo de oxígeno
El oxígeno es el componente número 8 de la tabla periódica. Uno es un componente excepcionalmente sensible que crea compuestos de una manera muy fácil (particularmente los óxidos) con elementos en general. Es un fuerte oxidante, con una alta electronegatividad. Después del hidrógeno y el helio, es el tercer elemento que más se encuentra. El oxígeno está relacionado persistentemente con los seres vivos. La proporción que tiene el oxígeno en el ambiente es del 20,8%.
El átomo de oxígeno, ya que tiene 8 electrones, termina la capa 1 con 2 electrones, y ubica 6 electrones en el segundo nivel. Con el objetivo final de terminar este segundo nivel con 8 electrones, en general capturará 2 electrones en sus enlaces compuestos con diferentes componentes, por lo que su estado de oxidación es – 2. El O2 es profundamente reactivo, particularmente formando óxidos. 2 átomos de oxígeno se juntan, a través de un enlace covalente, para crear la molécula de oxígeno O2.
El oxígeno es un destacado entre los componentes más electronegativos de la tabla periódica, esto implica que en general atrapará a los electrones y es un destacado entre los componentes más reactivo entre cualquiera de los demás componentes, creando así óxidos, sulfatos, nitratos. El oxígeno está incluido es un destacado entre los elementos más abundantes en la tierra, presente en el medio ambiente y que cubre una extensa parte del cuerpo humano (hecha de agua, H2O).
Átomo de nitrógeno
El nitrógeno es un elemento químico que ocupa el número atómico 7, se representa con el símbolo N, su peso atómico es 14.006 y en condiciones típicas da forma a un gas diatómico (nitrógeno diatómico o molecular) que comprende el 78% del aire en la atmósfera. Anteriormente se le identificaba con las letras “Az” y se le solía llamar azoe, aunque en algunas ocasiones se sigue haciendo.
El conocido nitrógeno elemental tiene una baja reactividad a la mayoría de las sustancias regulares, a temperaturas habituales. En altas temperaturas, suele reaccionar con cromo, silicio, titanio, aluminio, boro, berilio, magnesio, bario, estroncio, calcio y litio para formar nitruros; con O2, para enmarcar NO, y ante la presencia de un catalizador, con hidrógeno a temperaturas y presiones realmente altas, para crear amoniaco. El nitrógeno, el carbono y el hidrógeno se consolidan por encima de los 1800ºC (3270ºF) para dar forma al cianuro de hidrógeno.
En el punto en que el nitrógeno molecular se expone a la actividad de un electrodo de descarga con una liberación de alta frecuencia, es activado parcialmente a un intermediario inestable y regresa al estado basal con la descarga de un resplandor amarillo.
Los componentes de la familia del nitrógeno muestran tres estados de oxidación fundamentales, 3, +3 y +5 en sus mezclas, aunque también ocurren otros estados de oxidación. Todos los componentes de la familia del nitrógeno forman hidruros, y además óxidos +3, óxidos +5, haluros +3 (MX3) y, con la excepción del nitrógeno y el bimuto, haluros +5 (MX5). El nitrógeno es el componente más electronegativo de la familia. De esta manera, a pesar de las condiciones de oxidación de la familia (- 3, + 3 y +5), los marcos de nitrógeno se mezclan con otros estados de oxidación.
Átomo de cobre
El cobre es un elemento químico, el cual se representa con el símbolo Cu, con número atómico 29; Uno de los metales de “transición” y también un metal crítico no ferroso. Su utilidad se debe a la combinación de sus propiedades físicas, químicas y mecánicas y, además, a sus propiedades eléctricas y su cantidad. El cobre fue uno de los principales metales utilizados por las personas.
El grado del mineral utilizado en la generación de cobre ha ido disminuyendo de manera rutinaria, ya que los minerales más extravagantes han sido drenados y el interés por el cobre se ha expandido. Hay un montón de cobre en la tierra para utilizarlo en el futuro, si se utilizan los minerales que poseen grados inferiores, y no hay probabilidad de que se agoten en un lote significativo.
El cobre es el componente principal del subgrupo Ib de la tabla periódica y, además, incorpora los otros metales de estampación, plata y oro. Su átomo tiene la estructura electrónica 1s22s22p63s23p63d104s1. La baja capacidad de ionización del electrón 4s1 resulta en su simple evacuación para obtener cobre (I) o un ion cuprosa, Cu +, y cobre (II), o ion cúprico, Cu2 +, se enmarca sin problemas al expulsar un electrón de capa 3d.
El peso atómico del cobre es 63.546. Tiene dos isótopos comunes estables 63Cu y 65Cu. Hay además nueve isótopos inestables (radioactivos). El cobre se describe por su bajo movimiento de sustancias. Se consolida químicamente en una parte de sus estados de valencia concebibles. La valencia más conocida es la de 2+ (cúprica), aunque también es frecuente 1+ (cuprosa); además la valencia 3+ ocurre solo en un par de compuestos que son inestables.
Átomo de aluminio
El aluminio tiene un número atómico 13. Los 13 protones que enmarcan el núcleo están rodeados por 13 electrones orquestados en la forma: 1s22s22p63s23p1.
La valencia es 3 y las energías de ionización de los tres electrones iniciales son, individualmente: 577.5 kJ / mol, 1816.7 kJ / mol y 2744.8 kJ / mol. Hay dos isótopos en la naturaleza, 27Al y 26Al. El primero es estable, mientras que el segundo es radiactivo y su vida media es de 7.2 × 10^5 años. A pesar de esto, hay siete isótopos diferentes cuyo peso está en algún lugar en el rango de 23 y 30 unidades de masa nuclear.
Debido a esto, la generación de aluminio radiactivo se detiene cuando caen a tierra, debido a que la atmosfera filtra los rayos cósmicos en ese momento. El aluminio tiene tres radios iónicos en su estado de oxidación +3, dependiendo del número de coordinación que tenga el átomo. A fin de cuentas, tenemos que para un numero 4 el rango es de 53.0 pm, para 5 es de 62.0 pm y para 6 es de 67.5 pm.
Átomo de silicio
El silicio (del latín: “Silex”) es un componente químico metaloide, posee un número atómico 14 y se encuentra en la recopilación 14 de la tabla periódica de los componentes que poseen símbolo “Si”. Es el segundo componente más inagotable en la corteza de nuestro planeta (25,7% por peso) y viene ubicado después del oxígeno. Se puede encontrar en una forma indefinida y cristalizada; El primero es un polvo de tono parduzco, mucho más activo que la variación cristalina, que se encuentra en octaedros azules grisáceos y brillo metálico.
Átomo de hierro
El hierro es un elemento químico que se identifica con el símbolo “Fe”, su número atómico es el 26 y su peso atómico es de 55.847. Este elemento es el cuarto más encontrado en la corteza de nuestro planeta (5%). Es un metal flexible, tenaz con color y gres magnético y plateado. Los cuatro isótopos estables encontrados en la naturaleza tienen masas 54, 56, 57 y 58. Los dos minerales principales son hematita, Fe2O3 y limonita, Fe2O3.3H2O.
La utilización más amplia del hierro (fierro) es para adquirir acero básico; También se entregan grandes cantidades de metal fundido y metal forjado. Entre los diferentes usos del hierro y sus mezclas se encuentran el fabricado de imanes, colores (tintas, papel para heliográficos, tonos de pulidores) y abrasivos (colcótar).
Hay algunos tipos alotrópicos de hierro. La ferrita es estable hasta 760ºC (1400ºF). El ajuste en hierro B incluye principalmente la perdida de permeabilidad magnética, ya que la estructura del sistema (cúbico enfocado en el cuerpo) continua inalterada. El marco alotrópico tiene sus átomos en grupos cúbicos con prensado cerrado y es constante desde 910 a 1400ºC (1670 a 2600ºF). (Ver Articulo Sobre: Contaminación).
Átomo de helio
El helio (del griego: ἥλιος [hḗlios], “Sol”, se supuso en 1868 que existía en la atmósfera del sol) es un elemento químico el cual posee de número atómico el 2, se expresa con el símbolo “He” y su peso atómico estándar es de 4.0026. Tiene un lugar en el grupo número 18 de la tabla periódica, porque al tener el nivel de energía completo muestra las propiedades de un gas noble.
Es decir, no es activo (no reacciona) y, al igual que estos, es un gas monoatómico que no posee color ni olor, el cual tiene el punto de ebullición más reducido de todos los elementos químicos y solo puede llegar a licuarse con elevadas presiones y no puede solidificarse por congelamiento.
De los átomos polielectrónicos, el que tiene un número mínimo de electrones es el helio y su disposición electrónica ISO, que tiene un núcleo positivo, en el caso del He tiene una carga positiva de 2 u.a., y dos electrones. Necesitamos pensar en una disposición de tres cuerpos conectados entre sí por un potencial tipo Coulomb.
Átomo de sodio
La molécula de sodio está formada por 11 protones y 12 neutrones en el núcleo. Alrededor del núcleo del átomo de sodio se encuentran circulando un total de 11 electrones, que cubren los niveles de energía (2 electrones en el nivel primario, 8 en el segundo y 1 único en el último). Este último electrón lo pierde efectivamente, esa es la razón por la cual la carga química del sodio al unirse con otro componente es igual a +1.
Átomo de litio
Una partícula de litio tiene tres protones, tres neutrones y tres electrones. La condición de litio en su forma normal es sólida. El litio es un componente compuesto con un aspecto plateado / gris y tiene un lugar con el grupo de los alcalinos. El número atómico de litio es 3. El símbolo del elemento litio es Li.
El litio es profundamente corrosivo y requiere un cuidado extremadamente bueno, tiene el calor específico más elevado de todos los elementos sólidos. Su alto potencial electroquímico lo hace útil para utilizarlo en baterías, productos de cerámica y vidrio de uso especializado, por ejemplo, telescopios extensos.
Átomo de cloro
El cloro es un elemento que posee el número atómico 17 y se encuentra situado en el grupo de halógenos (grupo VIIA) de la tabla periódica. Se identifica con el símbolo “cl”. En condiciones típicas y en estado puro forma dicloro, el cual es un gas letal amarillo verdoso formado por átomos diatómicos (Cl2) aproximadamente 2.5 veces más pesado que el aire, olor desagradable y perjudicial. Es un componente abundante en la naturaleza y es un componente de esencial para algunos seres vivos.
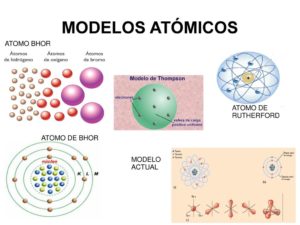
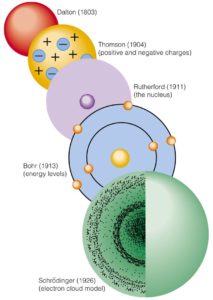
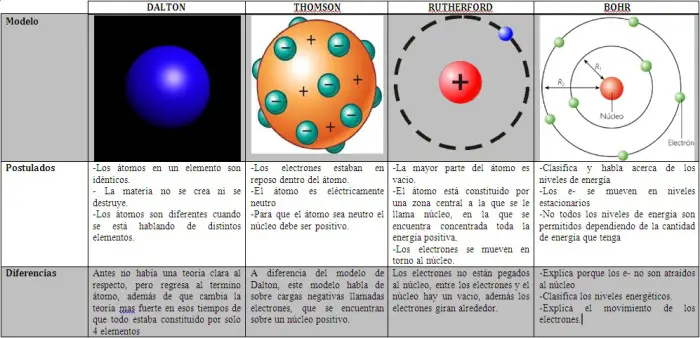
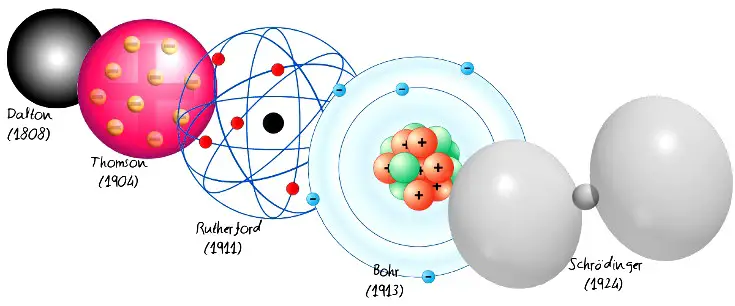
Modelo atómico de John Dalton
Este investigador fue el primero en detallar un modelo del átomo. Hizo para su modelo seis propuestas, entre las cuales reconoció que los átomos son indestructibles, a pesar del hecho de que a la vista son intangibles, encontró que los átomos de cada componente son equivalentes entre sí ya que coinciden con su peso y tamaño.
A continuación, podrás ver los Tipos de átomos imágenes según su modelo y los científicos que lo descubrieron:
Asimismo, confirmó que a pesar del hecho de que las los átomos se unen y las reacciones químicas son entregadas por dicha unión, no se dividen. Distinguió que, una y otra vez, los átomos de un elemento similar se pueden unir con otros en cantidades diferentes, de esta manera se forman dos mezclas distintas.
Modelo atómico de Thomson
La revelación más imperativa hecha por este investigador en relación con los átomos fue una sección que él llamó “el electrón” en el año 1897. En su propuesta, aclaró que los electrones se mantenían en una nube positiva, dispersos consistentemente. Para aclararlo, esencialmente dijo que la estructura atómica era como un budín con pasas, razón por la cual muchos consideran a este modelo el “modelo nuclear de budín de pasas”.
Modelo atómico de Rutherford
Según la hipótesis de los átomos de Rutherford, estos tienen un núcleo donde está ubicada el componente de la masa y enfoca toda su carga positiva, y una zona fuera de este donde se encuentran los electrones encontrados por Thomson.
Modelo atómico de Bohr
Modelo atómico de Schrödinger
El modelo detallado por este investigador funcionó excepcionalmente bien en unos pocos átomos, por ejemplo, el de hidrógeno. Representó a los electrones como “ondas de materia” que llegan a decaer cuando pasan el radio atómico.
A continuación, podrás ver los Tipos de átomos imágenes y los científicos que lo descubrieron:
Modelo nuclear de Sommerfeld
Este investigador tomó el modelo atómico de Bohr y lo mejoró al reparar una parte de los entrecruzamientos que tenía. Consideró entonces que los electrones podían girar en orbitas curvas o mejor dicho, elípticas, a diferencia del modelo de Bohr que simplemente imaginaba que los electrones podían girar una órbita circular. Además, propuso que el núcleo no se detiene, sino que de manera similar al electrón, se mueve alrededor del sistema de masas.
Estado fundamental
La condición fundamental de un sistema mecánico cuántico habla de su estado energético menos concebible o más bajo. La energía del estado fundamental también se denomina la energía de punto cero del marco o sistema. El estado energizado implica cualquier estado con energía más prominente que la del estado fundamental. El estado fundamental en la hipótesis del campo cuántico se conoce generalmente como vacío cuántico o vacío.
Como lo indica la tercera directriz de la termodinámica, un marco a temperatura cero suprema se encuentra en su estado fundamental, ya que su entropía está dictada por la decadencia del estado fundamental.
Numerosos marcos, por ejemplo, una estructura cristalina ideal, tienen un estado fundamental único y, en consecuencia, tienen cero entropía cuando están en el cero total, ya que el logaritmo de 1 es 0. También es viable para la condición de la más excitación tener la temperatura del cero supremo en los marcos que muestran la temperatura negativa. (Ver Articulo Sobre: Coniferas).
Como podrás ver otros Tipos de átomos imágenes y los científicos que lo descubrieron:
El estado fundamental en mecánica cuántica
El estado fundamental o crucial en la física, abrió las puertas de la mecánica cuántica en 1924, cuando Einstein y Bose, predijeron el Condensado Bose Einstein, y que se trata de que cuando los átomos pierden su identidad personal a las bajas temperaturas, se dice que los átomos están ubicados en un mismo nivel cuántico.
La energía, juega a un papel básico, ya que a las condiciones más bajas de temperatura, los átomos se suelen establecer también a su nivel más bajo de energía, mientras que a las condiciones normales, estos se encuentran en niveles de energía distintos, o dicho de otra forma, es un estado excitado (vibracional).
Molécula
En ciencia, se considera una molécula (proveniente del latín molécula, que es una abreviación de la palabra moles “masa”) es un grupo eléctricamente imparcial y adecuadamente estable de por lo menos dos átomos en una configuración caracterizada, unida por enlaces químicos sólidos (covalentes o enlaces iónicos).
En este sentido estricto, las moléculas contrastan con los iones poliatomicos. En las ciencias naturales y en la química orgánica, la palabra “molécula” se utiliza de una forma menos rigurosa y también es utilizada para referirse a mezclas orgánicas (moléculas orgánicas) y biomoléculas.
Anteriormente, la molécula se caracterizaba en una ruta menos amplia y exacta, como la pieza más pequeña de una sustancia que podía tener una presencia autónoma y estable, y que aún conservaba sus propiedades fisicoquímicas. Según esta definición, las moléculas monoatómicas podrían existir.
Una partícula puede formar parte de unos pocos átomos de un mismo elemento, como se aprecia en el caso del oxígeno diatómico (O2), o de diversos componentes, como en el caso del agua (H2O). Los átomos y los complejos conectados por enlaces no covalentes, por ejemplo, los enlaces de hidrógeno o los enlaces iónicos generalmente no se consideran moleculas individuales.
Diatómicos
Las moléculas diatómicas (del griego δι, dos y άτομον, átomo) son aquellas que están enmarcadas por dos átomos de un elemento químico equivalente o distintivo. Este curso de acción se debe a la presencia de un mínimo en potencial al que están sometidos los átomos. Los gases nobles no dan forma a los átomos diatómicos: esto se puede aclarar utilizando hipótesis orbital molecular.
Las moléculas diatómicas no pueden tener ninguna geometría que no sea recta, ya que dos de ellas deben caer en una línea. Esta es la instancia menos compleja del arreglo de átomos después del arreglo de átomos básicos.
Átomo del agua
El agua (H2O) es un compuesto de sustancia inorgánica formado por dos átomos de hidrógeno (H) y uno solo de oxígeno (O) . Este átomo es fundamental en la vida de los seres vivos, ya que se utiliza como un método para el metabolismo de biomoléculas. Se puede encontrar en la naturaleza en sus tres estados y fue crítico para su desarrollo. Es importante diferenciar entre el agua potable y el agua pura, ya que la primera es una mezcla que también contiene sales en su disposición; Esta es la razón por la cual el agua refinada se utiliza en las instalaciones de investigación y en diferentes territorios.
Henry Cavendish descubrió en 1781 que el agua era una sustancia compuesta en lugar de un solo elemento, como en otras ocasiones se creía. Los resultados de esta revelación fueron producidas por Antoine Laurent de Lavoisier (físico reconocido en diversos temas de la ciencia), descubriendo que el agua estaba compuesta de dos átomos de hidrógeno y un átomo de oxígeno.
En 1804, el experto científico francés Joseph Louis Gay-Lussac y el naturalista y geógrafo alemán Alexander von Humboldt distribuyeron un registro lógico que demostró que el agua estaba compuesta por dos volúmenes de hidrógeno por cada volumen de oxígeno (H2O).
La molécula del agua abarca una geometría no directa, con los dos átomos de hidrógeno formando un borde de 104.45 grados entre sí. Esta configuración, junto con la electronegatividad más notable del tamaño de un átomo de oxígeno, ofrece polaridad a dicha molécula, y su momento dipolar eléctrico es 6.2×10-30 C m. Este carácter dipolar de las moléculas de agua ofrece ascender al desarrollo de cuatro enlaces de hidrógeno con partículas abarcadoras.
¿Se puede dividir?
Los átomos tiene la posibilidad de acumular o perder energía cuando un electrón se mueve desde una órbita superior hasta una más inferior alrededor del núcleo. No obstante, la partición del núcleo de un átomo descarga una energía significativamente mayor que la de un electrón que pasa de una órbita superior a una inferior.
La división de un átomo se denomina fisión nuclear y la división repetida de los átomos se conoce como reacción en cadena. Este no es un procedimiento que pueda ser posible en casa. Solo puede realizar la división atómica en una instalación de investigación o planta nuclear que esté adecuadamente preparada. Las formas conocidas de dividir un átomo son:
- Bombardear isótopos radioactivos.
- Comprimir materiales radioactivos.
- Dividir átomos con un láser