Los Iones, suelen ser tanto como un átomo o una molécula que se encuentra cargada eléctricamente y que no suele ser neutra. En el siguiente artículo conoceremos cuales son los tipos de iones que existen, cómo son, cuáles son los que están cargados positivamente y cuáles son los que están cargados negativamente y mucho más
Indice De Contenidos
- 1 ¿Qué son los Iones?
- 2 Energía de la Ionización
- 3 Tipos de Iones
- 4 Ion Hidronio
- 5 Iones o Enlaces Covalentes
- 6 Iones Inorgánicos
- 7 Iones Poliatomicos
- 8 Iones del Agua
- 9 Iones de Sangre
- 10 Iones de Fosfato
- 11 Iones de Cloruro
- 12 Iones de Calcio
- 13 Iones de Sodio
- 14 Iones de Hidrógeno
- 15 Iones de Potasio
- 16 Iones de Litio
- 17 Iones de Amonio
- 18 Iones de Hidroxilo
- 19 Iones de Nitrato
- 20 Iones de Bicarbonato
- 21 Aplicaciones de los Iones
¿Qué son los Iones?
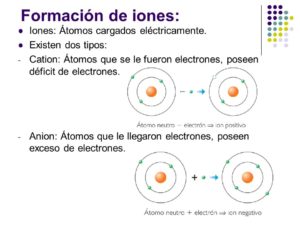
El Ion o los Iones el cual es tomado del idioma inglés y este del griego ἰών, “que va”; hasta el año 2010, ión, consiste en una partícula cargada eléctricamente la cual se encuentra constituida por un átomo o por una molécula que no suele ser eléctricamente neutro. De manera conceptual esto se puede llegar a entender como que, a partir de un tipo de estado neutro de un átomo o de una molécula, el cual se han ganado o perdido los electrones; este tipo de fenómeno se conoce como la ionización.
¿Cuántos tipos de iones existen? como podrás leer posteriormente, están los Catión que son los positivos y los Anión que son los negativos; de ellos se subdividen en otros que se mencionaran a continuación.
Significado de Anión y Catión
-
Anión significa “el que va hacia arriba” que posee una carga eléctrica negativa.
-
Catión significa “el que va hacia abajo” que posee una especie de carga eléctrica positiva.
Unas de las definiciones que suelen ser más formales son:
-
Un Catión consiste en una especie llamada monoatómica o también poliatómica que posee una o más cargas elementales del protón.
-
Un Anión consiste en una especie denominada monoatómica o poliatómica que posee una o más cargas elementales del llamado electrón.
Tanto Ánodo y cátodo utilizan el sufijo “odo”, que proviene del griego odos “οδος”, el cual tiene como significado camino o vía. La palabra:
Ánodo
Que significa “Camino Ascendente de la Corriente Eléctrica”. Es la zona en dónde ocurre o en donde se llega a producir la reacción de la oxidación, que tiende a provocar un aumento del estado de la oxidación.
Cátodo
Los Iones que se encuentran conformados por un solo átomo se les es denominado como Iones monoatómicos, a diferencia de los que se encuentran conformado por dos o más átomos, que se les llama Iones poliatómico.
Energía de la Ionización
La energía de ionización, es también denominada como potencial de ionización, el cual consiste en la energía que se debe de suministrar a 1 átomo neutro, gaseoso y en estado fundamental, para llegar a arrancarle el electrón más débil que es retenido.
-
X + 1ª energía de la ionización → X+ + e-
La energía necesaria para poder arrancar un 2do electrón el cual se denomina segunda energía de la ionización. Así de esa manera se puede deducir que el significado de la 3ra energía de la ionización y de las posteriores.
-
X+ + 2ª es la energía de la ionización → X2+ + e-
La energía de ionización se tiende a expresar en electrón – voltio, en julios o en kilojulios por mol ( kJ/mol ). El cual quedaría de la siguiente manera:
-
1 eV = 1,6.10−19 culombios × 1 voltio = 1,6.10−19 julios10
En los elementos de una misma clase de familia o grupo la clase de energía de ionización tiende a disminuir a medida que suele aumentar el número atómico, esto quiere decir, si va de arriba hacia abajo.
En el caso de los alcalinos, como por ejemplo, el elemento de una mayor potencial de la ionización tiende a ser el litio y en el caso del de menor potencial es el francio. Esto suele ser fácil de explicar, ya que al este descender en el grupo el último electrón se ubica en las orbitales por lo que se encuentran cada vez más alejados del núcleo y, además, los electrones de las capas centrales tienden a ejercer un efecto llamado de apantallamiento frente a la atracción nuclear sobre todo en los electrones periféricos por lo que suelen llegar a resultar más fácil extraerlos.
Esto suele deberse a que el electrón que es diferenciador se encuentra ubicado en el mismo nivel energético, mientras tanto que la carga del núcleo suele aumentar, por lo que llegará a ser mayor la fuerza de la atracción y, por otro lado, el número de las capas interiores no tiende a variar y el efecto del denominado apantallamiento no llega a aumentar.
Tipos de Iones
¿Qué tipos de iones existen? Existen diferentes varios tipos de iones entre los cuales se encuentran los Cationes, los Aniones, Plasma y otros tipos que son:
Iones Negativos
¿Cuáles son los tipos de iones llamados aniones? El anión consiste en una molécula que tiene una carga eléctrica que es del tipo negativa, que se tiende a generar como producto de haber llegado a obtener uno o más electrones. El anión tiende a ser lo contrario al catión, que es un tipo de iones con carga positiva. Se han llegado a descubrir de ciertos beneficios encontrados en los aniones, los cuales entre ellos incluyen: la incitación que suele generar en el conglomerado de las células que poseen como labor de proteger el cuerpo humano, esto se llega a conseguir ordenando y también orientando la resistencia ante algunas de las enfermedades.
De la misma manera, los aniones suelen eliminar las bacterias: cuando no tiende a existir el oxígeno, las bacterias se llegan a difundir, sin embargo, los aniones son los que brindan el oxígeno apropiado para que todas las primeras bacterias no puedan llegar a continuar con vida.
Por causa del corto rango de dicha interacción, los iones con carga negativa no tienden a presentar series de Rydberg. Un átomo de Rydberg es un tipo de átomo con 1 o más electrones que poseen un número cuántico principal el cual es muy alto.
Iones Positivos
¿Cuáles son los tipos de iones llamados cationes? se tienden a definir como los iones con carga positiva, esto es lo que significa que suelen ser los átomos con una carencia de los electrones en los orbitales de los exteriores. Los componentes que por lo general poseen más capacidad de poder ionizarse de una forma positiva, o sea, que los elementos que usualmente son los que pierden los electrones engloban a los metales, sin embargo, dicha propiedad puede llegar a verse en ciertos no metales, como entre otros elementos.
La extensión de los cationes tiende a ser pequeña, a diferencia de los aniones y de los átomos neutrales, esto es a causas de la carencia que posee de los electrones ubicados en la capa exterior.
Otros Tipos de Iones
Un dianión consiste en una especie que posee dos cargas negativas sobre ella. Por ejemplos de iones negativos esta el denominado dianión del pentaleno es uno aromático.
Un zwitterión es un tipo de ion con una carga neta igual a cero “0” sin embargo, este presenta dos cargas aisladas sobre la misma clase de especie que son iones positivos y negativos y, por lo tanto, tiende a ser neutro.
Los radicales iónicos consisten en los iones que comprenden un número que es irregular de los electrones y presentan una muy fuerte inestabilidad y también de reactividad.
El Plasma
Se llama plasma a un tipo de fluido gaseoso de los iones. Hasta incluso, se puede llegar a hablar del plasma en las muestras del gas corriente que lleguen a contener una proporción que tiende a ser apreciable de las partículas cargadas.
Se puede llegar a considerar a un plasma como un nuevo estado de la materia, es decir aparte de los estados:
-
Sólido
-
Líquido
-
Gaseoso
Que concrétamente es el cuarto estado de la materia, puesto que sus propiedades tienden a ser muy distintas a los estados usuales. Los plasmas de los cuerpos estelares son los que contienen, de una manera predominante, una especie de mezcla de los electrones y de los protones, y que se estima que la proporción de este es del 99,9 por ciento de todo el universo visible.
Isoelectrónicos
Dentro de los iones negativos y positivos se encuentran los iones isoelectrónicos que tienden a ser los iones que poseen una igual configuración electrónica, o más bien, visto desde otra forma, una igual cantidad de los electrones. Al llegar a comparar sus radios, se puede llegar a concluir algunas de las propiedades químicas que poseen ya que éstas tienden a cambiar entre el tipo de elemento en su estado elemental y en los iones. Un buen ejemplo sería:
Los Iones de configuración electrónica: 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – Cl-, S-2.
De todos éstos, se puede llegar a pensar que el ión de sulfuro tiende a ser el del tamaño mayor, por llegar a incrementar su densidad electrónica con dos electrones y posteriormente de ello sería el ión cloruro. Si se llegase a basar en estos datos, iones ejemplos:
-
El iónS-2 radio iónico = 184 pm
-
El iónCl- radio iónico = 181 pm
De estos dos se puede observar, que al llegar a compararlos, por ejemplo, que podría ser el ión sulfuro un tipo de mejor reductor que el ión de cloruro, por tener este una clase de densidad electrónica más grande y también más disponible, de la cuál aparte se trata de dos electrones, a diferencia del cloruro, que sólo se llega a referir a un electrón y se encuentra mas comprimida la densidad. Éso, se debería de ver en un valor reportado, como es el potencial:
-
S/S-2 E° = -0.407
-
Cl2/Cl- E° = 1.396
Ion Poliatómico
Otro de los grupos de iones negativos y positivos están los iones poliatómicos que son los que consisten en la agrupación de muchos átomos que se encuentran unidos de una forma química y son los que tienen tanto cargas negativas o positivas, y que suelen ser definidos como una unidad de los estímulos químicos. Dicha clases de iones denominados poliatómicos que son más usuales son los que contienen las cargas negativas.
Ion Monoatómico
El llamado ion monoatómico tiende a ser descrito como una especie de molécula que tiene una carga eléctrica. Este tipo de fenómeno suele ocurrir por consecuencia de que la molécula ha llegado a perder o también que ha obtenido los electrones.
Zwitterión
Este es uno de los tipos de iones positivos y negativos que tiene de forma simultánea una especie de área con una carga negativa y también otra con una carga positiva. Esto se debe al componente salino que posee, dicha clases de iones tiende a ser disoluble en el agua. Cuando se encuentra en una mezcla acuosa, puede ser posible categorizar un llamado ion zwitterión como de forma:
-
Positivo
-
Negativo
-
Neutral
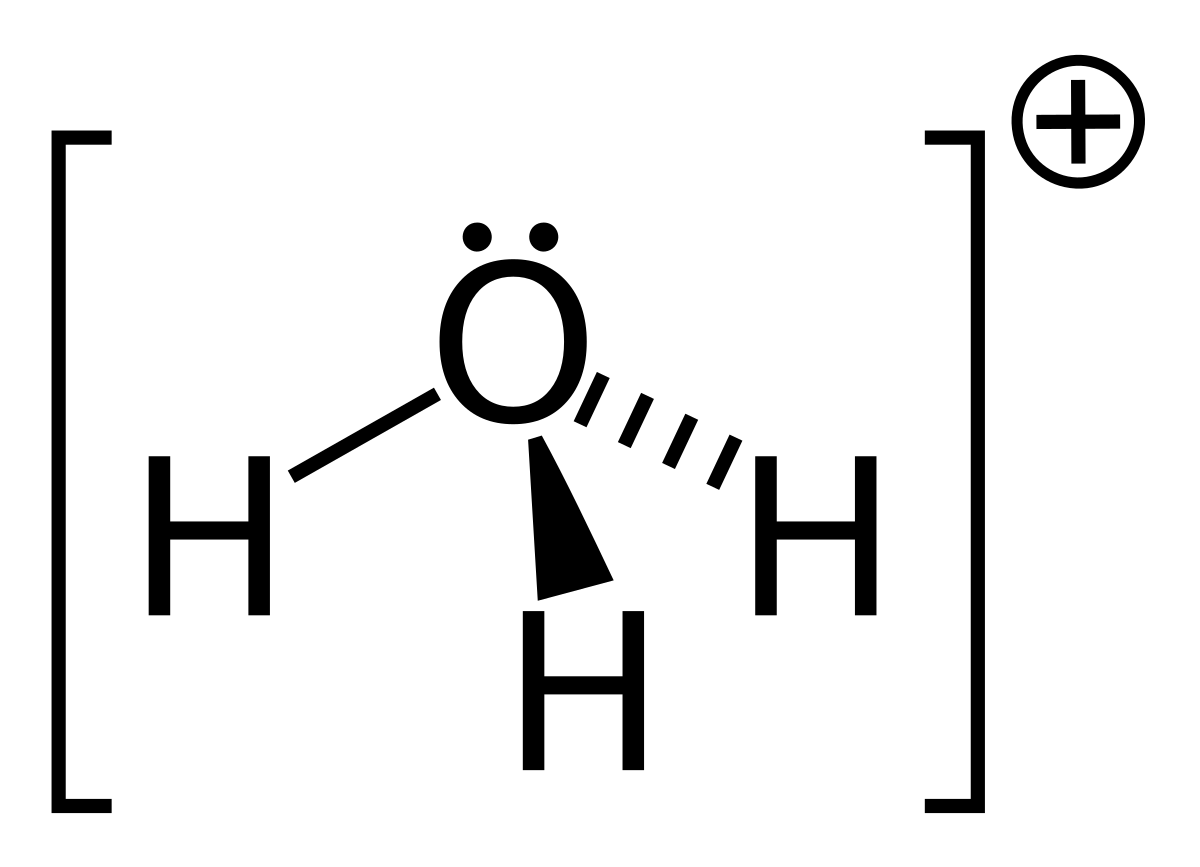
Ion Hidronio
¿Qué tipos de iones existen? dentro de los tipos de iones esta el ion hidronio que se considera un ion sencillo que procede de un estímulo químico entre una molécula de agua y un elemento ácido. El ion hidronio se puede ver en diversas formas, pudiendo ser líquido, gaseoso y sólido. Los iones hidronios existen en la atmósfera, sin embargo, es posible localizarlos en el espacio.
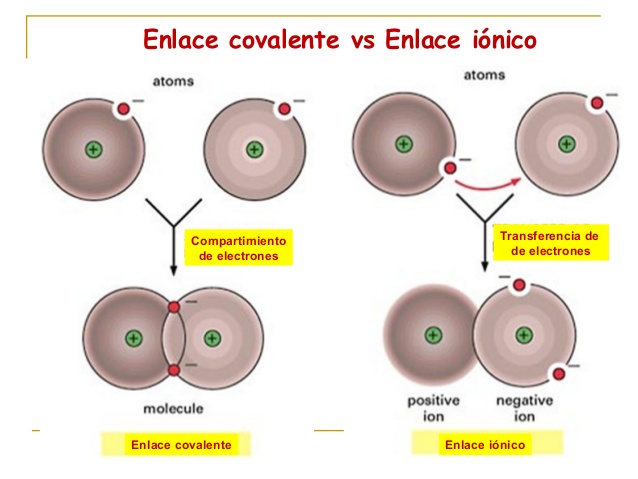
Iones o Enlaces Covalentes
Un tipo de enlace covalente entre unos dos átomos se tiende a producir cuando estos átomos se llegan a unir, para poder alcanzar el octeto estable, compartiendo los electrones del último nivel a excepción del hidrógeno que suele alcanzar la estabilidad cuando posee unos dos electrones. La diferencia de la electronegatividad entre los átomos no tiende a ser lo suficientemente grande como para que se llegue a producir una unión del tipo iónica. Para que un enlace que sea covalente se llegue a generar se requiere de que la diferencia de la electronegatividad entre los átomos tienda a ser menor a los 1,7.
De esta misma forma, los dos átomos suelen compartir uno o más pares electrónicos en un nuevo tipo de orbital, el cual es llamado orbital molecular. Los tipo de iones covalentes se tienden a producir entre los átomos de un mismo elemento no metal, entre los diferentes no metales y entre uno no metal y el hidrógeno.
Por el contrario, cuando los átomos de 1 mismo elemento de los no metálico se llegan a unir covalentemente, su diferencia de la electronegatividad tiende a ser cero “0” y no se crean los dipolos. Las moléculas entre sí tienen prácticamente una especie de atracción nula.
Iones Inorgánicos
Los iones inorgánicos pueden llegar a ser cationes, como por ejemplos de iones positivos son:
-
Cadmio
-
Plomo
-
Zinc
-
Mercurio
-
Hierro
-
Cobre
De los cuales se tienden a considerar como metales pesados a todos aquellos que poseen un carácter metálico y también los metaloides como por ejemplo As o Sb, con una densidad que suele ser superior a los 5 ó 6 g / cm³ y el número atómico tiende a ser mayor de 20. Sin embargo, algunos pueden llegar a ser esenciales como para las plantas, iones ejemplos:
Co – Cu – Fe – Mn – Mo – Zn
Para poder evaluar la contaminación tiende a resultar muy útil los AEF que son los factores de enriquecimiento antropogénico que se trata de la relación entre la abundancia de un llamado isótopo en un tipo de material enriquecido y de su abundancia en el material original. Para que esto se pueden llegar a realizar la:
“Determinación de los niveles de fondo y de los niveles de la referencia de los metales pesados y también de los otros elementos traza en los suelos de la Comunidad de Madrid”
Un libro muy suele ser muy interesante que tiende a calcular los niveles naturales de los diferentes tipos de metales en la Comunidad de las regiones de Madrid y en la que se tiende a apoyar la legislación regional para llegar a decidir si un suelo se encuentra o no contaminado este es el Real Decreto 9/2008.
Los efectos que son causados de los metales pesados tienden a ser las alteraciones que son debidos a que:
-
Compiten por los lugares activos
-
Reaccionan con los grupos SH
-
Producen los daños irreversibles en las membranas
-
Poseen un muy importante efecto acumulativo
Para llegar a descender a más detalle se tendría que poder estudiar cada tipo de metal con una gran detenimiento. Los aniones son también los que producen efectos en el medioambiente, en los nitratos y en el caso de los fosfatos son los que producen eutrofización o el cianuro que tiende a bloquear la cadena de transporte de los electrones.
Iones Poliatomicos
Un llamado ion poliatómico, es también conocido como el ion molecular, el cual se trata de un ion que se encuentra compuesto por dos o más átomos covalentemente lso cuales están enlazados o de un tipo de complejo metálico que puede llegar a considerarse como una sola unidad en el tipo de contexto de la química de los ácidos y también de las bases o en la formación de las sales.
Estos tipos de iones son también los que se definen como una especie química, ya sea un átomo o una molécula respectivamente cada una con su carga eléctrica. Esto es a lo que se debe a que ha llegado a ganar o en ciertos casos a perder los electrones en una reacción química. Los iones con carga negativa son los producidos por la ganancia de los electrones y son llamados aniones, y los que son cargados positivamente como una consecuencia de la pérdida de electrones, son los denominados cationes.
Iones del Agua
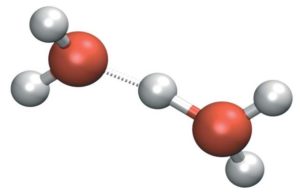
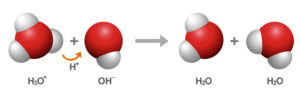
El agua pura es un tipo de electrolito débil que se tiende a disociar en una muy baja proporción en sus iones de hidronio o de hidrógeno H3O+ este también puede ser escrito como H+, y el hidróxido o hidróxilo OH–. Unas dos moléculas polares de agua pueden llegar a ionizarse a causa de las fuerzas de la atracción por los puentes de hidrógeno que se llegan a establecer entre ellas.
Debido a que en el agua que es pura por cada 1 ion de hidronio o un ion hidrógeno existe un ion hidróxido o de hidroxilo, pero la concentración suele ser la misma. Las concentraciones de los hidronios que de la misma manera son denominados de protones ( H+ ) y de los hidroxilos ( OH- ) que tienden a ser inversamente proporcionales; esto quiere decir, para que el tipo de valor de la constante de la disociación se llegue a mantener como tal, el aumento de 1 de las concentraciones tiende a implicar la disminución de la otra.
Iones de Sangre
Los iones en la sangre son un tipo de elemento el cual es muy fundamental en la regulación de las funciones del organismo de los seres vivos. Estos tienden a ser el producto de la separación de los llamados electrolitos con el agua y son los que pueden llegar a ser tanto iones positivos como negativos.
Cuando el átomo suele perder los electrones o los gana tiende a pasar de un estado al otro. En estos tipos de caso se les denominan iones positivos y negativos por la carga eléctrica. Sin embargo, lo más importante es la clase de carga o también los valores normales de los iones en la sangre ya que a partir de todos ellos pueden llegar a aparecer las alteraciones electrolíticas a partir de la llamada ionización, la pérdida o la ganancia de los electrones.
Iones de Fosfato
Los fosfatos tienden a ser las sales o también los ésteres del ácido fosfórico. Estos poseen en común un tipo de átomo de fósforo que está rodeado por unos 4 átomos de oxígeno en una forma tetraédrica.
Los fosfatos secundarios y los terciarios tienden a ser insolubles en el agua, a excepción del:
-
Sodio
-
Potasio
-
Amonio
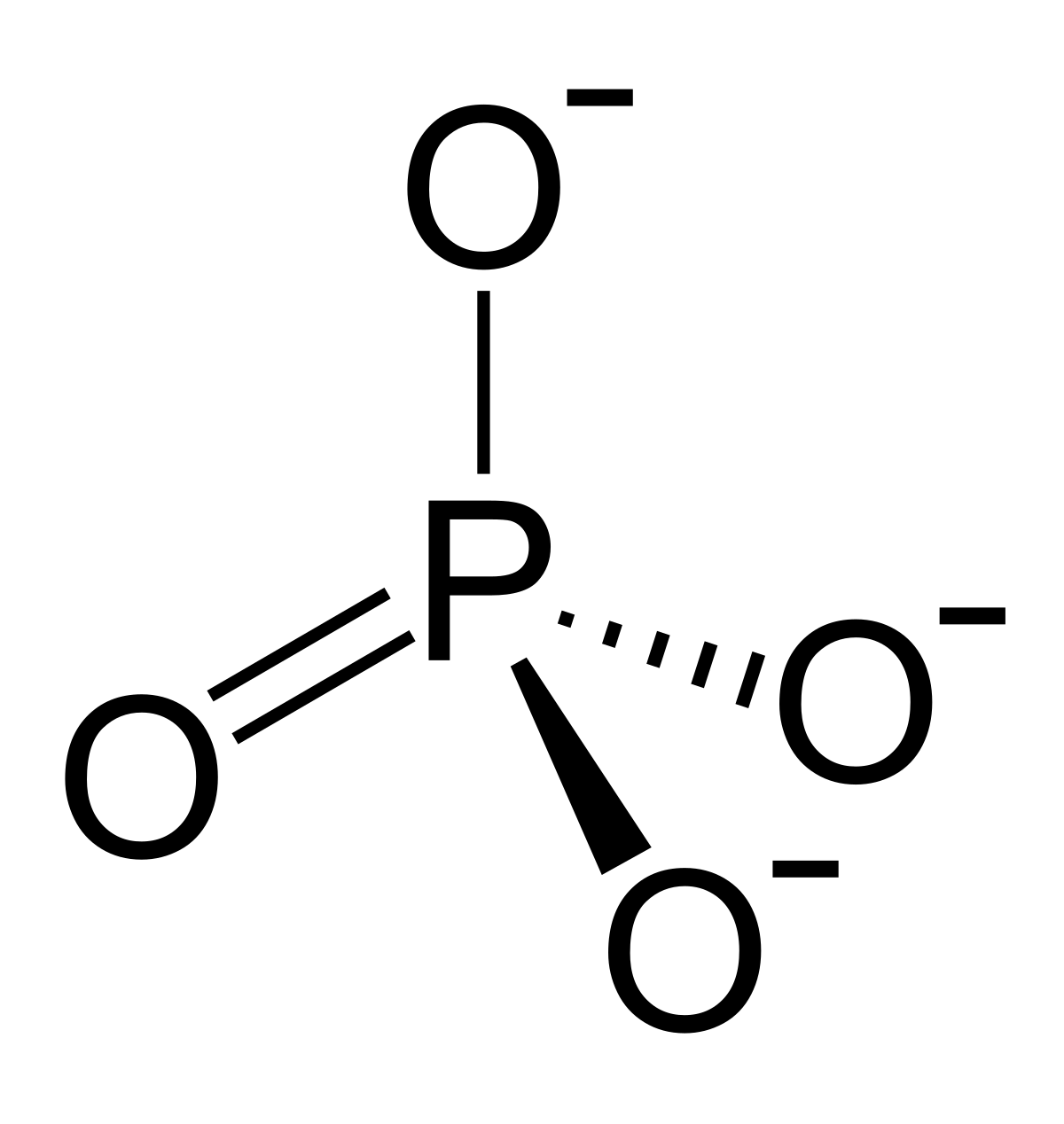
Los Ortofosfatos
Los fosfatos que son más avanzados tienden a ser los llamados ortofosfatos con el prefijo de ” orto ” se tienden a llamar a los ácidos que están más hidratados. Ellos contienen el anión PO43-. Los ortofosfatos se localizan de una forma amplia y también distribuidos en la naturaleza, sobre todo en su forma de apatita y son los que forman parte esencial de los dientes y los huesos.
También tienden a ser los compuestos indispensables en la formulación de los llamados abonos minerales. Su ausencia es lo que limita el crecimiento de las plantas. Habitualmente en la jardinería se llegan a utilizar los abonos ricos en fosfato para poder inducir y hasta fortalecer la floración de los mismos. En la industria de la alimentación los ortofosfatos como por ejemplo en su forma de fosfato de sodio tienden a ser usados en algunos de los casos en la elaboración del queso procesado.
Los fosfatos tienden a formar una parte muy importante de la carga en las aguas residuales. Pueden llegar a ser eliminados por los métodos fisicoquímicos precipitándolos con el cloruro ferrico ( FeCl3 ) o también suelen ser retenidos en los fangos activos que se tienden a separar y posteriormente pueden llegar a ser reconvertidos en el compost para los abonos orgánicos.
Grupo Fosfato
El grupo de fosfato es un tipo de ion poliatómico de una fórmula empírica que es PO43− y de una masa molecular que es de 94,97 daltons; este se encuentra compuesto por 1 átomo central de fósforo el cual está rodeado por 4 átomos que son idénticos de oxígeno en una disposición tetraédrica.
En una disolución acuosa, el fosfato existe en unas 4 formas. En las condiciones de pH muy básico tiende a predominar el ion fosfato ( PO43− ), mientras tanto que en las situaciones de basicidad intermedia se puede encontrar el ion fosfato de hidrógeno ( HPO42− ). En las condiciones de la acidez baja, se puede observar el ion dihidrógeno fosfato ( H2PO4− ). A una mayor acidez, se tiende a presentar en el ácido fosfórico ( H3PO4 ).
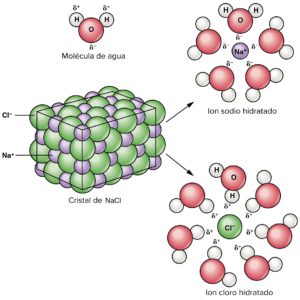
Iones de Cloruro
Los cloruros tienden a ser los compuestos que llevan un átomo de cloro en un estado de oxidación formal que es -1. Por lo tanto estos corresponden al estado de oxidación más bajo de dicho elemento ya que este tiene a estar completada la capa de la valencia con unos 8 electrones.
Características Generales
Los cloruros inorgánicos son los que contienen el anión Cl− y por lo tanto tienden a ser las sales del ácido clorhídrico ( Hcl ). Este se suele tratar de las sustancias sólidas incoloras con un alto punto de fusión. En ciertos casos el enlace con el metal puede llegar a tener algún carácter covalente. Esto se llega a notar por ejemplo en el cloruro de mercurio ( I I) de fórmula ( HgCl2 ) que es el que sublima a las temperatura que están bastante bajas. Por esto se conocía esta clase de sal antiguamente con la denominación de “sublimato”.
El cloruro de hierro que es el ( III ) de fórmula ( FeCl3 ) de la misma manera este muestra cierto carácter covalente. Así puede llegar a ser extraído de 1 disolución con una alta concentración de cloruro con éter y sin tener presencia del agua de la cristalización sublima a unas altas temperaturas. La mayor parte de los elementos de cloruros con la excepción principalmente del:
-
Cloruro de Mercurio que es el ( I ) de fórmula ( Hg2Cl2 )
-
Cloruro de Plata de una fórmula ( AgCl )
-
Cloruro de Talio que es (I) de una fórmula ( TlCl )
Los cuales los 3 tienden a ser bastante solubles en el agua. En presencia de los oxidantes fuertes como por ejemplo de:
-
Permanganato
-
Bismutato
-
Agua Oxigenada
-
Hipoclorito, etc.
Los cloruros pueden llegar a ser oxidados a un cloro elemental. Esta clase de oxidación se puede llegar a llevar también a cabo por la electrólisis. De hecho la llamada electrólisis del cloruro sódico en la disolución es el tipo de método el cual es el más empleado para llegar a obtener este tipo de elemento además del hidróxido de sodio.
Iones de Calcio
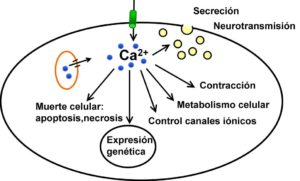
El ion calcio es un tipo de mensajero intracelular el cual es utilizado por las numerosas hormonas y también los neurotransmisores para poder activar las múltiples funciones celulares, desde la contracción o también la secreción hasta la expresión de los genes. Las implicaciones fisiológicas de este tipo de ión tienden a ser por tanto muy diferentes, que van desde su papel en los tejidos secretores o en el músculo hasta la transmisión sináptica.
En la actualidad suele ser evidente que las señales de calcio tienden a ser una especie de código heterogéneo que se llega a adaptar a las funciones de cada tipo celular. Este tipo de código puede llegar a considerarse como una clase de idioma o lenguaje celular, de los cuales cuyos componentes son los que empiezan hoy en día a revelarse.
Canales de Calcio
Los canales de calcio tienden a ser canales iónicos es decir las estructuras macromoleculares transmembrana, las cuales suelen ser provistas de un poro y son ubicadas en la membrana plasmática de las células que son los que permiten la entrada de los iones Ca2+ al citosol y por lo tanto, son los que hacen que tiende a aumentar la concentración intracelular de dicho ion, produciendo de esta manera una despolarización, que es lo que constituye una clase de señal para la activación de las diversas funciones celulares.
Iones de Sodio
El sodio es un tipo de elemento químico de símbolo Na que del idioma latín es, natrium con un número atómico “11” que llegó a ser aislado por un hombre llamado sir Humphry Davy en el año 1807. Este es un tipo de metal:
-
Alcalino Blando
-
Untuoso
-
De Color Plateado
-
Muy abundante en la Naturaleza
Llegándose a encontrar en la sal marina y también en el mineral halita. Este tiende a ser muy reactivo, el cual suele arder con llama amarilla, se tiende a oxidar en presencia del oxígeno y también es el que reacciona de forma violenta con el agua. El sodio se encuentra presente en unas grandes cantidades en el océano en una forma iónica. También tiende a ser un componente de diversos minerales y un tipo de elemento el cual es esencial para la vida.
Características Principales
En las condiciones que son apropiadas este reacciona de forma espontánea en el agua. Por lo general no tiende a arder en contacto con el aire por que está por debajo de los 40 °C.
Iones de Hidrógeno
El Ion de Hidrógeno tiende a ser el término el cual suele ser recomendado por la IUPAC como una especie de término general para todos los iones del hidrógeno y sus isótopos. Esto es dependiendo de la carga eléctrica del ion, los cuales se pueden llegar a distinguir en unos dos tipos que son los iones positivos y negativos:
El Catión “Cargado Positivamente”
Como ejemplos de iones positivos se encuentran los:
-
Ion Hidronio.
-
Catión Zundel.
Cuando el hidrógeno suele perder su electrón, se tienden a formar los siguientes cationes:
-
El Hidrón: este es el nombre general el cual es referido a uno de los 10 iones positivos de cierto isótopo de hidrógeno ( H+ ).
-
Protón: 1H+ que es más correctamente llamado, el catión del protio.
-
Deuterón: De una fórmula 2H+, D+
-
Tritón: De fórmula 3H+, T+
Además, los iones tienden a ser generados por la reacción de dichos cationes con el agua, así como también sus hidratos los cuales son denominados iones hidrógeno:
-
Ion Hidronio: H3O+
-
Catión Zundel: H5O2+
-
Catión Eigen: H9O4+
Los 2 últimos son los que desempeñan un papel muy importante en el salto de los protones de acuerdo con el tipo de mecanismo de Grotthuss. En relación con los ácidos, los iones del hidrógeno son normalmente los que se refieren al llamado ion hidronio.
Anión “Cargado Negativamente”
Los aniones hidrógeno se tienden a formar cuando estos adquieren los electrones adicionales, como ejemplos de iones negativos se encuentran:
-
El Hidruro: este es el nombre general el cual es referido al ion negativo de cierto isótopo de hidrógeno
-
Deuteruro: 2H-, D-
-
Tritiuro: 3H-, T-
En la química orgánica, es un tipo de átomo de hidrógeno en una molécula que tiende a ser a menudo nombrado simplemente como 1 protón. El anión de hidrógeno es le que juega un papel muy importante en la física cuántica.
Iones de Potasio
Se trata de uno de los métodos para poder llegar a determinar la composición corporal determinando la cantidad de la masa grasa y de la masa magra corporal. En esta clase de técnica se tiende a determinar la cantidad de un isótopo natural, que es el potasio.
El potasio suele ser el principal ion del interior de las células. Este junto con el sodio, son los que constituyen la llamada bomba de sodio – potasio, lo cual es el elemento esencial para llegar a generar un potencial eléctrico en las membranas celulares. El mantener una carga eléctrica en la membrana de las células tiende a ser imprescindible para que se puedan llegar a transmitir los llamados impulsos nerviosos. El potasio también es requerido para poder llegar a transportar los nutrientes al interior celular y de esa manera expulsar todos los productos de desecho al llamado medio extracelular.
Respecto a la dietética, el potasio es el que interviene en el metabolismo de los hidratos del carbono y también en la síntesis de las proteínas. En definitiva, las funciones principales del potasio tienden a ser muchas y también suelen ser muy variadas. La alteración de sus niveles puede llegar a producir a ciertos problemas de tipo:
-
Neurológico
-
Endocrino
-
Muscular
-
Cardiovascular
Iones de Litio
Los iones de Litio suelen ser utilizados por lo general para la elaboración de la llamadas baterías de Litio. La batería de iones de litio, son también llamadas como batería de Li-Ion, el cual consiste en un dispositivo diseñado para el almacenamiento de la energía eléctrica que tiende a ser empleada como los electrolito que es una sal de litio que se trata de los iones que son necesarios para la reacción electroquímica de forma reversible que posee lugar entre el cátodo y el ánodo.
Iones de Amonio
El Amonio suele ser también una clase de nombre general para las aminas que son sustituidas y cargadas positivamente o las protonadas y los cationes de amonio cuaternario, en donde uno o más de los átomos de hidrógeno se encuentran reemplazados por los grupos radicales orgánicos.
Propiedades ácido-base
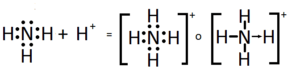
El ion de amonio se tiende a generar cuando el amoníaco, que es una base débil, suele reaccionar con los ácidos Bronsted que son:
H+ + :NH3 = NH4
La disociación ácida de forma constante de NH4 suele ser 9.25.
El ion amonio tiende a ser ligeramente ácido, el cual es el que reacciona con las bases de Bronsted para de esa manera volver a la molécula de amoniaco sin carga:
NH4 + B = HB + NH3
Por lo tanto, el único tratamiento de las soluciones concentradas de las sales de amonio con la base fuerte da al amoniaco. Cuando el amoníaco se llega a disolver en el agua, una mínima cantidad de la misma se tiende a convertir en los iones de amonio:
NH4 + + OH- = NH3 + H2O
El grado en el cual este ion amoníaco se llega a formar solamente depende del pH de la solución. Si el tipo de pH tiende a ser bajo, el equilibrio se llega a desplazar hacia la derecha:
más moléculas de amoniaco se llegan a convertir en los iones de amonio. Si el pH tiende a ser alto, el equilibrio se llega a desplazar hacia la izquierda:
El ion de hidróxido es el que abstrae un tipo de protón del ion amonio, por lo que ocurre la generación del amoniaco.
Iones de Hidroxilo
Los hidróxidos tienden a ser un grupo de compuestos químicos los cuales son formados por 1 metal y el grupo funcional del OH, que es el ion hidróxido, OH-, el cual es llamado grupo de hidróxido, que tiende a actuar con el número de oxidación -1. No se debe de confundir el ion hidróxido con el radical hidroxilo. El hidróxido, es la combinación que se deriva del agua por la sustitución de 1 de sus átomos de hidrógeno por 1 metal, que se encuentra presente en diversas bases.
El grupo de hidroxilo consiste en un grupo funcional el cual es formado por 1 átomo de oxígeno y el otro de hidrógeno, este es característico de los:
-
Alcoholes
-
Fenoles
-
Ácidos Carboxílicos entre otros de los compuestos orgánicos.
Es muy común el equivocar el nombre de hidroxilo para llegar a referirse al anión OH-, el cual es llamado hidróxido, 1 de los iones poliatómicos que son más simples y los más importantes que se encuentra en los hidróxidos. Este tipo de ion se encuentra formado por un oxígeno y un hidrógeno y su carga eléctrica tiende a ser -1. El grupo de O-H sin carga, posee un electrón sin llegar a compartir que se ubica sobre el oxígeno y se suele representar como el •OH , o también como el OH•.
Formulación
Los hidróxidos se tienden a formular escribiendo el tipo de metal seguido del grupo que es dependiente con la base de un ion de radical adecuado con el hidroxido; éste es el que va entre el paréntesis si el subíndice tiende a ser mayor de uno. Se nombran usando la palabra hidróxido el cual es seguida del nombre del metal, con la indicación de su valencia, si llegase a tener más de una. Por ejemplo, el:
-
Ni ( OH )2 se trata de el hidróxido de níquel (II)
-
Ca ( OH )2 consiste en el hidróxido de calcio
Las disoluciones de forma acuosas de los hidróxidos poseen carácter básico, ya que éstos se tienden a disociar en el catión metálico y de los iones de hidróxido. Esto suele ser de esa manera debido a que el enlace entre el metal y el grupo hidróxido es del tipo iónico, mientras tanto que el enlace entre el oxígeno y el hidrógeno tiende a ser covalente. Por ejemplo:
- Na OH (aq) → Na+(aq) + OH-
Los hidróxidos son los que resultan de la combinación de 1 óxido básico con el agua. Los hidróxidos son también conocidos con el nombre de bases. Estos son los compuestos por las sustancias que en la solución tienden a producir a los iones hidroxido. En la clasificación mineralógica llamada de Strunz se les tiende a englobar dentro del grupo de los óxidos, sin embargo, existen bibliografías que los tienden a tratan como un grupo aparte. Los hidróxidos se tienden a clasifican en:
-
Básicos
-
Anfóteros
-
Ácidos.
Por ejemplo, el Zn ( OH )2 es un tipo de hidróxido anfótero ya que:
-
Con Ácidos: Zn(OH)2 + 2H+ → Zn+2 + 2H2O
-
Con Bases: Zn(OH)2 + 2OH− → [Zn(OH)4]−2
Iones de Nitrato
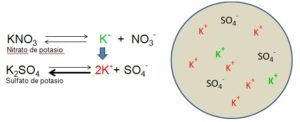
Los Nitratos tienden a ser las sales que poseen en común la presencia del llamado ion nitrato con una fórmula ( NO3-) como por ejemplo:
-
Nitrato de Sodio → NaNO3
-
Nitrato de Amonio → NH4NO3
-
Nitrato de Potasio → KNO3
-
Nitrato de Calcio → Ca(NO3)2
-
Nitrato de Bario → Ba(NO3)2
-
Nitrato Férrico → Fe(NO3)3
Los Nitratos se encuentran presentes en la naturaleza en unas grandes cantidades. Un buen ejemplo tiende a ser el salitre que consiste en una mezcla de nitrato de sodio ( NaNO3 ) y de el nitrato de potasio ( KNO3 ).
Síntesis de los Nitratos
Los Nitratos suelen ser sales que se tienden a derivar del Ácido Nítrico ( HNO3 ) principalmente de la reacción de este con las bases sin embargo, también existen los otros métodos. Las siguientes reacciones que mencionaremos son unos ejemplos de la síntesis de ciertos nitratos los cuales son:
- HNO3 + NH4OH → NH4NO3 + H2O
- HNO3 + NaOH → NaNO3 + H2O
- 2 HNO3 + Na2CO3 → 2 NaNO3 + CO2 + H2O
- HNO3 + KOH → KNO3 + H2O
- 6 HNO3 + Ca3(PO4)2 + 12 H2O → 3 Ca(NO3)2 + 2 H3PO4 + 12 H2O
Un proceso natural el cual es bastante curioso de la síntesis de los nitratos es el que se tiende a producir con las descargas eléctricas que son procedentes de las tormentas. En ellas, el elemento de N2, el O2 y el vapor de agua ( H2O ) tienden a reaccionar para de esa manera formar el ácido nítrico ( HNO3 ). Este es el que ataca los minerales tales como los carbonatos a partir de los cuales se tienden a formar los nitratos.
Propiedades de los Nitratos
En el ion nitrato ( NO3- ) el tipo de nitrógeno se llega a encontrar con estado de oxidación de +5 y este es el que ocupa el centro de un triángulo de 3 átomos de oxígeno, casi todos las clases de nitratos tienden a ser solubles en el agua. Los nitratos suelen ser potencialmente tóxicos al llegar a convertirse fácilmente en los nitritos ( NO2− ), los cuales suelen ser las llamadas sustancias cancerígenas de el Nitrato de sodio ( NaNO3 ) que son las sustancia incolora, inodora. Este suele ser altamente un oxidante.
Iones de Bicarbonato
Los bicarbonatos tienden a ser sales ácidas las cuales son derivadas del ácido carbónico ( H2CO3 ) que son los iones positivos y negativos que contienen el anión bicarbonato ( HCO3- ).
El bicarbonato que es más importante suele ser el bicarbonato de sodio o tambien conocido como el hidrogenotrioxidocarbonato de sodio, de una fórmula NaHCO3. Este es debido a su solubilidad en el agua el cual es un intermedio de forma clave en el proceso de la obtención del carbonato de sodio el cual es según el proceso de Solvay.
Las Aplicaciones
Al tratarse de las sales de 1 ácido débil los bicarbonatos que tienden a ser solubles poseen carácter básico. Así el bicarbonato de sodio suele ser parte esencial de diversas formulaciones de los antiácidos estomacales. El mismo tipo de compuesto de la misma manera es utilizada en los extintores de polvo.
Aplicaciones de los Iones
Los iones tienden a ser muy esenciales para la vida. Los iones de:
-
Sodio
-
Potasio
-
Calcio y Otros más
Tienden a jugar un papel muy importante en la biología celular de todos los organismos vivos o seres vivos, en particular en las denominadas membranas celulares. Existen multitud de aplicaciones las cuales se encuentran basadas en el uso de los iones y cada día se llegan a descubrir más, desde los detectores de humo hasta los llamados motores iónicos
Los iones inorgánicos que se encuentran disueltos suelen ser un componente de los sólidos es decir de los sólidos totales disueltos que se encuentran presentes en el agua y son los que indican la calidad de la misma.
Iones Frecuentes
En las siguientes tablas podrás observar cuantos tipos de iones existen, su nombres, formulas, entre otros:
|
Nombre Común |
Fórmula |
Nombre Tradicional |
|---|---|---|
|
Cationes Simples |
||
|
Aluminio |
Al3+ |
Aluminio |
|
Bario |
Ba2+ |
Bario |
|
Berilio |
Be2+ |
Berilio |
|
Cesio |
Cs+ |
Cesio |
|
Calcio |
Ca2+ |
Calcio |
|
Cromo (II) |
Cr2+ |
Cromoso |
|
Cromo (III) |
Cr3+ |
Crómico |
|
Cromo (VI) |
Cr6+ |
Percrómico |
|
Cobalto (II) |
Co2+ |
Cobaltoso |
|
Cobalto (III) |
Co3+ |
Cobáltico |
|
Cobre (I) |
Cu+ |
Cuproso |
|
Cobre (II) |
Cu2+ |
Cúprico |
|
Galio |
Ga3+ |
Galio |
|
Helio |
He2+ |
(partícula α) |
|
Hidrógeno |
H+ |
(Protón) |
|
Hierro (II) |
Fe2+ |
Ferroso |
|
Hierro (III) |
Fe3+ |
Férrico |
|
Plomo (II) |
Pb2+ |
Plumboso |
|
Plomo (IV) |
Pb4+ |
Plúmbico |
|
Litio |
Li+ |
Litio |
|
Magnesio |
Mg2+ |
Magnesio |
|
Manganeso (II) |
Mn2+ |
Hipomanganoso |
|
Manganeso (III) |
Mn3+ |
Manganoso |
|
Manganeso (IV) |
Mn4+ |
Mangánico |
|
Manganeso (VII) |
Mn7+ |
Permangánico |
|
Mercurio (II) |
Hg2+ |
Mercúrico |
|
Níquel (II) |
Ni2+ |
Niqueloso |
|
Níquel (III) |
Ni3+ |
Niquélico |
|
Potasio |
K+ |
Potasio |
|
Plata |
Ag+ |
Argéntico |
|
Sodio |
Na+ |
Sodio |
|
Estroncio |
Sr2+ |
Estroncio |
|
Estaño (II) |
Sn2+ |
Estanoso |
|
Estaño (IV) |
Sn4+ |
Estánico |
|
Zinc |
Zn2+ |
Zinc |
Los Catión Poliatómico es un grupo de sustancias que provienen de un protón, es decir, de un ión de hidrógeno.
|
Nombre Común |
Fórmula |
Nombre Tradicional |
|---|---|---|
|
Cationes poliatómicos |
||
|
Amonio |
NH4+ |
|
|
Hidronio u Oxonio |
H3O+ |
|
|
Nitronio |
NO2+ |
|
|
Mercurio (I) |
Hg22+ |
Mercurioso |
Aniones Frecuentes
Estos aniones son los llamados generalmente simples.
|
Nombre formal |
Fórmula |
Nombre alternativo |
|---|---|---|
|
Aniones simples |
||
|
Arseniuro |
As3− |
|
|
Azida |
N3− |
|
|
Bromuro |
Br− |
|
|
Carburo |
C4− |
|
|
Cloruro |
Cl− |
|
|
Fluoruro |
F− |
|
|
Fosfuro |
P3− |
|
|
Hidruro |
H− |
|
|
Nitruro |
N3− |
|
|
Óxido |
O2− |
|
|
Peróxido |
O22− |
|
|
Sulfuro |
S2− |
|
|
Yoduro |
I− |
|
Un punto interesante en este tema es el oxoanión, pues este es uno de los iónes ión poliatómico. Aquí puedes ver la tabla de cuales pertenecen a él:
|
Nombre formal |
Fórmula |
Nombre alternativo |
|---|---|---|
|
Oxoaniones |
||
|
Arseniato |
AsO43− |
|
|
Arsenito |
AsO33− |
|
|
Borato |
BO33− |
|
|
Bromato |
BrO3− |
|
|
Hipobromito |
BrO− |
|
|
Carbonato |
CO32− |
|
|
Hidrógenocarbonato |
HCO3− |
Bicarbonato |
|
Clorato |
ClO3− |
|
|
Perclorato |
ClO4− |
|
|
Clorito |
ClO2− |
|
|
Hipoclorito |
ClO− |
|
|
Cromato |
CrO42− |
|
|
Dicromato |
Cr2O72− |
|
|
Yodato |
IO3− |
|
|
Nitrato |
NO3− |
|
|
Nitrito |
NO2− |
|
|
Fosfato |
PO43− |
|
|
Hidrógenofosfato |
HPO42− |
|
|
Dihidrógenofosfato |
H2PO4− |
|
|
Permanganato |
MnO4− |
|
|
Fosfito |
PO33− |
|
|
Sulfato |
SO42− |
|
|
Tiosulfato |
S2O32− |
|
|
Hidrógenosulfato |
HSO4− |
Bisulfato |
|
Sulfito |
SO32− |
|
|
Hidrógenosulfito |
HSO3− |
Bisulfito |
|
Silicato |
SiO4−4 |
|
También se encuentran los Aniónes de ácidos orgánicos que pertenecen a los iónes negativos, son sustancias químicamente heterogéneas que poseen un esqueleto de carbono y una carga negativa neta. Los aniones orgánicos son bases conjugadas de ácidos orgánicos. La siguiente tabla enumera algunos de los aniones orgánicos y sus ácidos conjugados que son sustratos de la transportador de ácido orgánico (OAT) la familia de proteínas transmembrana. Visualiza la tabla para que puedas ver cuales son los que pertenecen a él:
|
Aniones de ácidos orgánicos |
|||
|---|---|---|---|
|
Acetato |
C2H3O2− |
||
|
Formiato |
HCO2− |
||
|
Oxalato |
C2O42− |
||
|
Hidrógenoxalato |
HC2O4− |
Bioxalato |
|
|
Otros aniones |
|||
|
Hidrógenosulfuro |
HS− |
Bisulfuro |
|
|
Telururo |
Te2− |
||
|
Amiduro |
NH2− |
||
|
Cianato |
OCN− |
||
|
Tiocianato |
SCN− |
||
|
Cianuro |
CN− |
||
|
Hidróxido |
OH− |
||