Los Isótopos, son los átomos de 1 mismo elemento de los cuales los núcleos que poseen tienen una cantidad de neutrones que es diferente por esta razón el número másico difiere entre ellos. En el siguiente artículo conoceremos todo lo referente a los Isótopos, cuales son los tipos, que usos se les da y mucho más referente a ellos.
Indice De Contenidos
- 1 ¿Qué son los Isótopos?
- 2 Notación
- 3 Características de los Isotópos
- 4 ¿Para qué sirven los Isótopos?
- 5 Riesgos
- 6 Importancia de los Isótopos
- 7 Los Radioisótopos – Radioactivos
- 8 Tipos de Isótopos
- 9 Ejemplos de los Isótopos
- 10 Isótopos del Hidrógeno
- 11 Isótopos del Carbono
- 12 Isótopos del Oxígeno
- 13 Isótopos del Cloro
- 14 Isótopos del Uranio
- 15 Isótopos del Azufre
- 16 Isótopos del Magnesio
- 17 Isótopos del Litio
- 18 Isótopos del Nitrógeno
- 19 Isótopos del Calcio
- 20 Isótopos del Hierro
- 21 Isótopos del Fósforo
- 22 Isótopos del Potasio
- 23 Isótopos del Helio
- 24 Isótopos del Cobre
- 25 Isótopos del Zinc
- 26 El Cobalto
- 27 Los Isóbaros
- 28 Isótopos Estables
- 29 Isótopos Estables en la Tabla Periódica
- 30 Usos de los Isótopos
- 31 Tabla Periódica
- 32 Isótopos más Abundantes en el Sistema Solar
- 33 Aplicaciones de los Isótopos
- 34 Utilización de las Propiedades Químicas
¿Qué son los Isótopos?
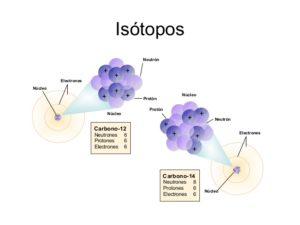
¿Qué son los Isótopos? Se llaman isótopos a los átomos de un mismo elemento, los cuales cuyos núcleos poseen una cantidad que es diferente de los neutrones, y por lo tanto, estos difieren en el número másico. La palabra Isótopo se utilizan para llegar a indicar que todas las clases de isótopos de átomos de 1 mismo elemento químico denominados isótopos que se encuentran en el mismo lugar de la tabla periódica.
La gran mayoría de los elementos químicos poseen más de 1 Isótopo. Solamente unos 8 elementos de isótopos ejemplos como:
-
Berilio
-
Sodio
Son los que poseen 1 solo isótopo natural. En contraste, el llamado estaño es el elemento con más cantidad de isótopos estables para ser más específicos son unos 10.
Otros de los elementos que poseen isótopos naturales tienden a ser inestables, son el elemento del uranio, de los cuales cuyos isótopos pueden llegar a transformarse o también a decaer en los otros isótopos que son más estables, llegando a emitir en el proceso de la radiación, por lo que se dice que estos tienden a ser radiactivos.
Los isótopos que suelen ser inestables tienden a ser útiles para llegar a estimar la edad de 1 gran variedad de las muestras naturales, los isótopos ejemplos son las rocas y la materia orgánica. Esto llega a ser posible, siempre y cuando, se llegue a conocer el ritmo promedio de la desintegración de un determinado isótopo, en cuanto a la relación a los que ya habían decaído. Gracias a este tipo de método de datación, se puede llegar a sacar la conclusión de un aproximado de la edad del Planeta Tierra.
Notación
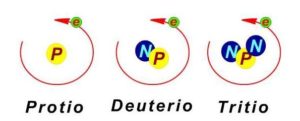
En el comienzo los nombres de los isótopos de cada unos de los elemento que se iban llegando a descubrir recibieron los nombres propios diferentes al del elemento al que ellos pertenecían. Así como cuando se descubrieron 3 isótopos del hidrógeno, ellos recibieron los nombres de:
-
Protio
-
Deuterio
-
Tritio
El núcleo del primero el protio consta de tan solo 1 protón, el del segundo que es el deuterio de 1 protón y de 1 neutrón, y el del tercero que es el tritio de 1 protón y 2 neutrones.
De esa manera los isótopos del hidrógeno se tienden a denotar como:
-
Protio (11H )
-
Deuterio ( 12H )
-
Tritio, ( 13H )
Como todos los isótopos de 1 mismo elemento poseen el mismo número atómico, que tiende a ser el del orden en la tabla periódica, y el del mismo símbolo, habitualmente se suele elidir el número atómico. Así para los isótopos del hidrógeno escribiremos el:
-
1H
-
2H
-
3H
En el caso de los textos no científicos, como los textos periodísticos, esta clase de notación con los subíndices y los superíndices tiende a ser más incómoda, por lo que también se utiliza una notación consistente en el nombre de cada elemento unido por un guion (-) al número másico del isótopo de que se trate. De esta manera los isótopos del hidrógeno que son el:
-
11H
-
12H
-
13H
También se pueden llegar a nombrar como el:
-
hidrógeno -1
-
hidrógeno -2
-
hidrógeno -3 respectivamente.
Estas suelen ser las reglas de la nomenclatura que fueron científicamente aceptadas, correspondientes a la Nomenclatura de Química Inorgánica. Las recomendaciones del año 2005 del Libro Rojo de la IUPAC, tal cual y como se pueden llegar a encontrar en su sección IR – 3.3.
Se debe de recordar que los nombres de los elementos químicos tienden a ser nombres comunes y como tales se deben de escribir sin mayúscula inicial, salvo en los casos que otra regla ortográfica lo llegue a imponer.
Características de los Isotópos
Entre las características principales de los Isotópos encontramos las siguientes:
-
Ellos poseen el mismo número de los protones.
-
Son las mismas especies de elemento químico.
-
Ellos difieren en el número de los neutrones y en el numero másico.

Las características de los isótopos por lo general tienen las mismas propiedades químicas, ya que esta clase de propiedades solo tienden a depender del número atómico, como suele ser en el caso de la solubilidad. Sin embargo estos pueden llegar a presentar diversas propiedades físicas a causa de que sus masas tienden a ser diferentes: un ejemplo de estos es la densidad.
¿Para qué sirven los Isótopos?
Los isótopos poseen muchas utilidades los cuales suelen ser muy importantes en muchas ramas por lo que pueden llegar a utilizarse tanto en la:
-
Agricultura
-
Industria de los Alimentos
-
Control de las Pestes
-
Arqueología
-
Medicina
¿Para qué sirven los isótopos? Estos sirven también en la medicina como estamos mencionando anteriormente, por ejemplo, en el caso de la emisión de los rayos gamma para llegar a detectar los tumores dentro del cuerpo humano. La irradiación de estos es lo que elimina grandes cantidades de diferentes tipos de bacteria, lo que puede permitir que los alimentos lleguen a ser más seguros de poder ingerir.
Riesgos
El principal riesgo que procede de los isótopos, en especial de los que tienden a ser radioactivos, es su inhalación o en el caso de la ingesta. Cuando esto llega a suceder, se puede afectar lo que es el ADN, la producción de las proteínas y es lo que tiende a aumentar el riesgo de llegar a padecer diversas enfermedades y también los cánceres. Los efectos de la radiación siempre van a llegar a depender de cuanto fue la cantidad que ingresó en el organismo.
Importancia de los Isótopos
Los isotopos tienden a ser muy importantes debido al gran uso que se le llegan a dar, como por ejemplo:
-
En el área de la Medicina en los llamados rayos gamma
-
En la Química para poder encontrar el origen de ciertos átomo después de una reacción química
-
En la Geología o Biología es importante para llegar a determina la antigüedad de algunas cosas.
-
Y por último podemos mencionar en el área de la Física Nuclear, se utilizan en la fisión y la Fusión Nuclear para llegar a producir la energía limpia.
Los Radioisótopos – Radioactivos
Los radioisótopos son los isótopos radiactivos ya que poseen 1 núcleo atómico que es inestable y tiende a emitir una energía y las partículas cuando se transforman es decir que decaen en un isótopo diferente que es más estable. La energía que es liberada al llegar a decaer puede llegar a detectarse con un contador de Geiger o también con una película fotográfica.
Esto llega a suceder por causa de que la fuerza nuclear fuerte residual llega a depender de la proporción de los neutrones y también de los protones.
Varios de los isótopos radiactivos que son inestables y los artificiales poseen usos en las técnicas de radioterapia en la medicina. Como por ejemplo, 1 isótopo del tecnecio que es el “99mTc”, en donde la “m” indica que es un isómero nuclear metaestable, que puede llegar a usarse para poder identificar los vasos sanguíneos que están bloqueados. Varios de los isótopos radiactivos que son naturales se utilizan en la datación radiométrica para poder determinar las cronologías, por ejemplo, en la arqueológia.
Tipos de Isótopos
Por ejemplo, en el caso de la naturaleza del carbono este se presenta como 1 especie de mezcla de 3 isótopos con los números másicos que son “12, 13 y 14: 12C, 13C y 14C”. Sus abundancias en cuanto a respecto a la cantidad global de carbono tienden a ser respectivamente 98,89 %, 1,11 % y a trazas.
La clasificación de los isótopos se encuentran en 2 tipos que son los naturales y los Artificiales:
Isótopos Naturales
Los isótopos naturales son todos aquellos que se llegan a encontrar en la naturaleza. Como por ejemplo, el hidrógeno posee 3 isótopos naturales que son el:
-
Protio
-
Deuterio
-
Tritio.
¿Para qué sirven los isótopos? El tritio suele ser muy usado en los trabajos del tipo nuclear; este es el elemento que tiende a ser esencial de la bomba de hidrógeno. Otro de los elementos que se encuentran formado por los isótopos que suele ser muy importantes es el carbono, que es el:
-
Carbono – 12, que tiende a ser la base referencial del peso atómico de cualquier tipo de elemento.
-
Carbono-13 que suele ser el único carbono con las propiedades magnéticas.
-
Carbono-14 Radiactivo, este tiende a ser muy importante ya que su semivida que tiende a ser de 5.730 años y se suele utilizar mucho en la arqueología para llegar a determinar la edad de los fósiles orgánicos.
Otro de estos elementos naturales es el uranio – 235 el cual se utiliza en las centrales nucleares y también en las conocidas bombas atómicas.
Isótopos Artificiales
Los isótopos artificiales se llegan a producir en los laboratorios nucleares por el bombardeo de las partículas subatómicas o también en las centrales nucleares. Estos tipos de isótopos suelen llegar a tener 1 clase de vida corta, principalmente por la gran inestabilidad y la radioactividad que tienden a presentar. Uno de estos tipos de isótopos artificiales es el cesio, de los cuales cuyos isótopos se utilizan en plantas nucleares para la generación eléctrica.
Los isótopos artificiales se tienden a subdividir en isótopos estables de los cuales tan solo existen menos de 300 y los isótopos no estables o isótopos radiactivos que suelen existir alrededor de unos 1.200. El concepto de la estabilidad no tiende a ser exacto, ya que existen algunos isótopos que son casi estables. Su estabilidad se suele deber al hecho de que, no obstante tienden a ser radiactivos, estos poseen un periodo de semidesintegración que suele ser extremadamente largo en comparación con la edad del Planeta Tierra.
Ejemplos de los Isótopos
Algunos de los ejemplos de Isótopos tienden a ser:
El Hidrógeno
Se conocen unos 3 isótopos del elemento hidrógeno que son:
-
El 11H este es el hidrógeno más ligero y también el más abundante.
-
El 21H este suele ser el deuterio ( D ), del cual cuyo núcleo tiende a albergar 1 protón y también 1 neutrón.
-
El 31H que tiende a ser el tritio ( T ), del cual cuyo núcleo es el que contiene 1 protón y 2 neutrones.
El Oxígeno
El Uranio
El uranio tiene 3 isótopos que son naturales que son el:
-
Uranio 238 poseen unos 92 protones + 146 neutrones lo que es = 238 nucleones. Este es el isótopo más común del uranio con 1 abundancia de más del 99,28 %.
-
Uranio 235 que posee unos 143 neutrones y puede llegar a ser capaz de poder provocar y llegar a mantener una reacción nuclear en cadena.
-
Uranio 234 que posee unos 421 neutrones y es el más escaso de todos.
Isótopos del Hidrógeno
El elemento del hidrógeno tiene 3 isótopos que suele ser conocidos los cuales son los siguientes:
-
1H1 – protio que es de aproximadamente el 99,98%.
-
1H2 – Deuterio: Este es el hidrógeno que tiene 1 neutrón es de más o menos el 0,015%.
-
1H3 – Tritio: Es el hidrógeno que tiene 2 neutrones, siendo este el tipo radioactivo.
Isótopos del Carbono
El carbono posee unos 2 isótopos naturales y 1 inestable que suelen ser:
-
6C12 – Carbono 12, este es el más abundante en la Tierra que corresponde el 98,89%.
-
6C13 – Carbono 13, es el menos abundante se encuentra cerca del 1,01 al 1,14%.
-
6C14 – Carbono 14: Se trata de 1 isótopo inestable, el cual es radioactivo y por esta misma razón se le utiliza para hacer los proceso de datación de los restos geológicos.
Isótopos del Oxígeno
El oxígeno – 18 ( 18O ) tiende a ser el segundo isótopo más abundante del oxígeno posteriormente del oxígeno – 16 ( 16O ). Este es un isótopo estable que aparece naturalmente en el medio ambiente. La abundancia de estas clases de isótopos en la naturaleza tiende a ser del 0,2 %.
Este se llega a utilizar junto al deuterio en los estudios de la hidrología, como una especie de trazador para llegar a entender el origen de las aguas meteóricas.
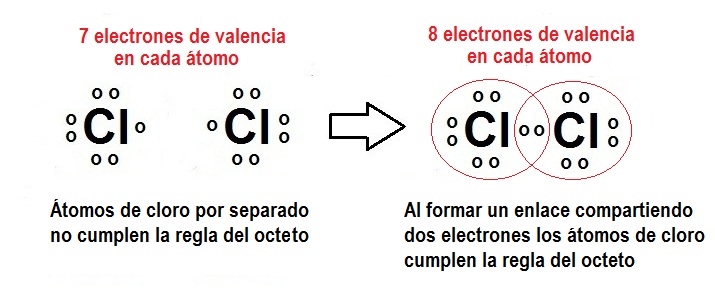
Isótopos del Cloro
El cloro ( Cl ) posee unos 24 isótopos que tienden a abarcar el rango que es comprendido entre el 26Cl y el 51Cl. De todos ellos, 2 son isótopos estables y son el:
-
35Cl
-
37Cl
Con unas abundancias naturales que van de:
-
75,78 %
-
24,22 %, respectivamente.
- 29Cl
- 30Cl
Con unos períodos de semidesintegración que tienden a ser inferiores a los 20 y 30 ns, respectivamente. El período de semidesintegración del 28Cl todavía sigue siendo desconocido. En la naturaleza se encuentran 2 isótopos estables de cloro. Uno de ellos de masa 35 uma, y el otro es de 37 uma, con unas proporciones que son relativas de 3:1 respectivamente, lo que da un peso atómico para el cloro de unos 35,5 uma.
El cloro posee unos 9 isótopos con masas desde 32 uma hasta 40 uma. Solo 3 de ellos se encuentran en la naturaleza y son el:
-
35Cl, que es estable y con 1 abundancia del 75,77 %.
-
37Cl, este también es estable y con una abundancia del 24,23 %.
-
Isótopo Radiactivo 36Cl.
La relación del 36Cl con el Cl estable en el ambiente tiende a ser de aproximadamente 700 × 10−15:1.
Isótopos del Uranio
El uranio – 235 ( 235U ) este tiende a ser el único isótopo fisible, esto quiere decir, que cuenta con una capacidad para llegar a provocar una reacción en cadena de la fisión nuclear, que se encuentre presente en la naturaleza, esta es una característica que ni siquiera el mismo uranio – 238 posee, siendo el más común de este tipo de elemento. El mismo llegó a ser descubierto en el año 1935 por un hombre llamado Arthur Jeffrey Dempster. Éste presenta un tipo de período de semidesintegración de unos 700 millones de años.
El uranio – 235 se llega a distinguir por ser el único elemento que se llega a encontrar en la naturaleza que es un tipo de isótopo fisionable. El uranio – 238 es fisionable por los neutrones rápidos, y también es un tipo de material fértil que puede llegar a transmutarse en 1 reactor nuclear en plutonio – 239 que también es fisionable.
Mientras que el uranio – 238 tiene una pequeña probabilidad de fisión espontánea o que al llegar a ser bombardeado por los neutrones rápidos, el uranio – 235 tiene una mayor probabilidad de llegar a fisionarse al ser bombardeado por los neutrones térmicos, por lo que esta es la principal reacción responsable de la generación del calor en 1 reactor nuclear, y es también la principal fuente de material fisible para las armas nucleares.
Los 2 usos de los isótopos tienden a ser posibles por la capacidad del uranio de llegar a sostener 1 reacción nuclear en cadena.
La fisión de un átomo de 235U tiende a generar unos 200 MeV = 3,2·10-11 J, es decir unos, 18 TJ / mol = 77 TJ / kg.
|
Isótopos del Uranio |
|||||||||||||||||||||||||||||||||||||||||||
|
|---|
Isótopos del Azufre
Se conocen al menos unos 25 isótopos del azufre, de los cuales 4 de ellos tienden a ser estables y son el:
-
S-32 con un 95,02 %
-
S-33 con el 0,75 %
-
S-34 con un 4,21 %
-
S-36 con ta solo el 0,025 %
Aparte del S-35, que tiende a ser formado al incidir la radiación cósmica sobre el argón – 40 atmosférico y que posee un periodo de semidesintegración de unos 87 días, los demás isótopos que son radiactivos son de una vida corta.
Isótopos del Magnesio
El magnesio-26 es un tipo de isótopo estable que se tiende a emplear en la datación radiométrica, de la misma forma que el Al-26, del que suele ser hijo. En las CAI que son las inclusiones ricas en calcio y aluminio de ciertos meteoritos, los objetos que son más antiguos del sistema solar, se han llegado a encontrar las cantidades de Mg-26 que tienden a ser mayores de las esperadas que se atribuyen al decaimiento del Al-26.
Dichos objetos, cuando se han llegado a desprender en las etapas tempranas de la formación de los planetas y de los asteroides no han llegado a sufrir los procesos geológicos que tienden a hacer que desaparezcan las estructuras condríticas las cuales son formadas a partir de las inclusiones y por lo tanto guardan información sobre la edad del sistema solar.
Isótopos del Litio
Los isótopos estables del litio tienden a ser 2 y son el:
-
Li-6
-
Li-7
Siendo este último el más abundante de todos con un 92.5 %. Se han llegado a caracterizar 6 radioisótopos siendo los más estables el denominado Li-8 con un tipo de periodo de semidesintegración de unos 838 milisegundos y el Li-9 con un periodo de 178.3 ms. El resto de los isótopos radiactivos poseen unos periodos de semidesintegración que son menores de unos 8,5 ms. También se tiende a dar, en los laboratorio, el isótopo inestable Li-11.
Isótopos del Nitrógeno
Existen 2 isótopos estables del nitrógeno que son el:
-
N-14
-
N-15
Isótopos del Calcio
El Calcio ( Ca ) posee un total de 24 isótopos, desde el 34Ca al 57Ca. Existen unos 5 isótopos estables que son observacionalmente entre ellos están el:
-
40Ca
-
42Ca
-
43Ca
-
44Ca
-
46Ca
Más un isótopo que es 48Ca con una vida que tiende a ser media larga de tal manera que para todos los propósitos prácticos, puede llegar a ser considerado como estable. El isótopo que es más abundante, es decir el 40Ca, así como también el más raro que es el 46Ca, tienden a ser teóricamente inestables por las razones energéticas, sin embargo, su desintegración no ha llegado a ser observada.
El calcio también posee 1 isótopo cosmogénico, el radiactivo 41Ca, que tiene un tipo de período de semidesintegración de unos 102.000 años. A diferencia de lo que son isótopos cosmogénicos que suelen ser producidos en la atmósfera, el 41Ca es producido por la activación de los neutrones del 40Ca.
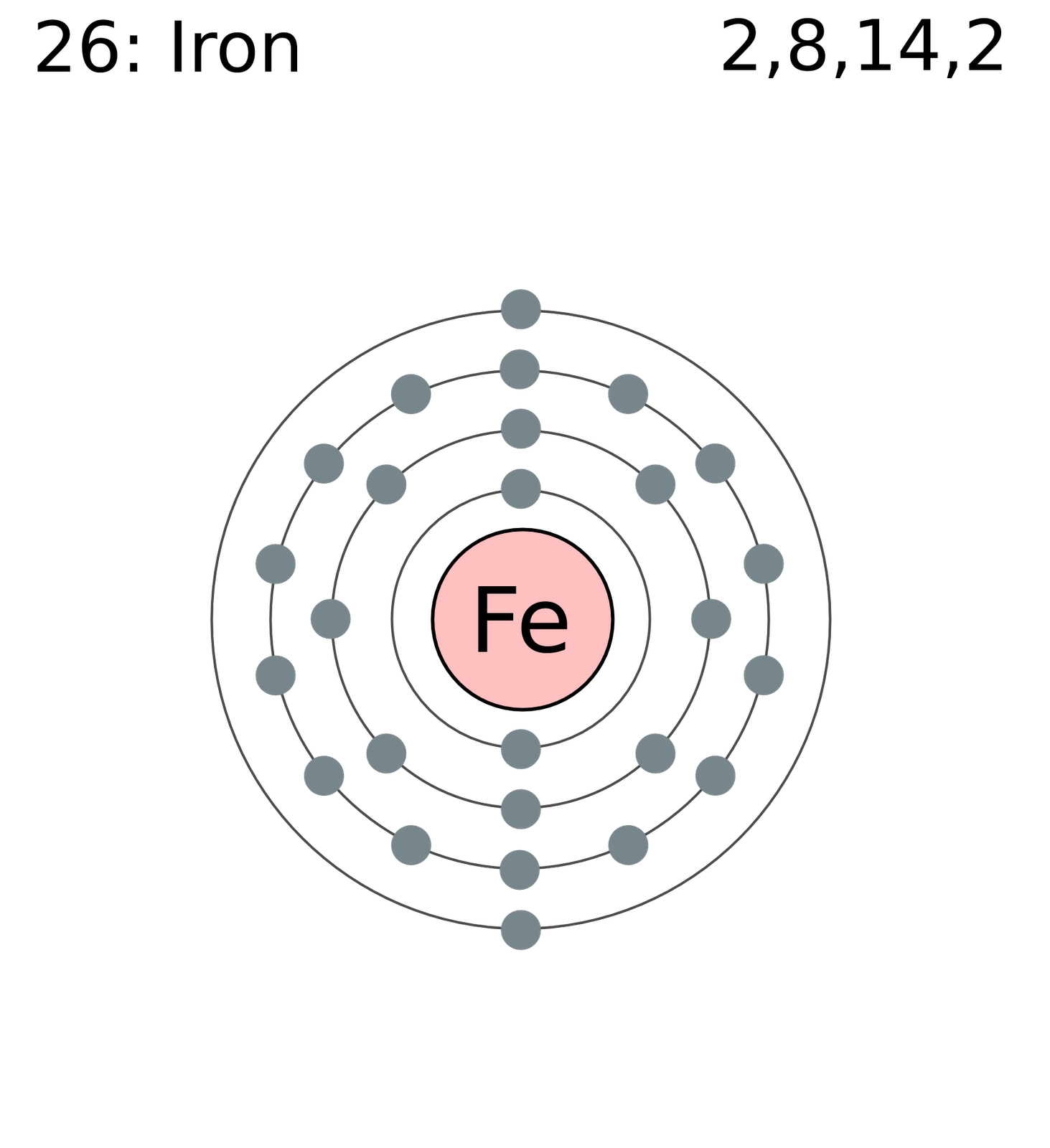
Isótopos del Hierro
El hierro posee unos 4 isótopos que son naturales los cuales tienden a ser los siguientes el:
- 54Fe
- 56Fe
- 57Fe
- 58Fe
Con una cierta presencia respecto del total de hierro en la tierra que es de un:
-
5.845 %
-
91.754 %
-
2.119 %
-
0.282 %, respectivamente.
Además, el 54Fe es un tipo de isótopo que puede ser probablemente radioactivo con 1 vida media que es superior a los 3.1 × 1.022 años. Se llegan a conocer los 24 radioisótopos.
Gran parte del trabajo que se ha llegado a realizar en la medición de la composición isotópica del hierro se ha estado centrando en poder determinar las variaciones del 60Fe a causa de los procesos que acompañan la nucleosíntesis por ejemplo: en los estudios de los meteoritos y en la formación de los minerales.
En el último período, sin embargo, los avances en cuanto a la tecnología de la espectrometría de las masas han llegado a permitir la detección y también la cuantificación de las variaciones de un origen natural en los radios de lo que son isótopos estables de hierro. Mucho de este tipo de trabajo ha llegado a ser dirigido por las comunidades de la geociencia y de la ciencia planetaria, sin embargo, las aplicaciones a los sistemas biológicos y también los industriales se encuentran surgiendo.
La Masa atómica estándar de este es: 55.845(2) u
Isótopos del Fósforo
El fósforo ( P ) posee unos 23 isótopos que tienden a abarcar el rango que se encuentra comprendido entre el 24 P y el 46 P, siendo el 31P el único de todos ellos que suele ser estable, por lo que el fósforo llega a ser considerado un elemento monoisotópico.
Isótopos del Potasio
El potasio ( K ) tiene unos 24 isótopos que tienden a abarcar el rango comprendido entre el 32K y el 56K. Entre todos ellos, se encuentran 3 isótopos naturales de los cuales 2 son isótopos estables y son el:
-
39K ( 93,3% )
-
41K ( 6,7 % )
Y 1 es un radioisótopo con un muy largo período de semidesintegración que es el:
- 40K ( 0,012 % )
El radioisótopo 40K, que se localiza en la naturaleza, se llega a desintegrar el 10,72% de las veces llegando a generar el 40Ar estable mediante la captura electrónica o por la emisión de los positrones llegando a originar el núclido emisor de los positrones con un mayor período de semidesintegración conocido. De manera alternativa, la mayor parte de las veces es decir un 89,28%, la desintegración posee lugar por medio de la desintegración beta generando el 40Ca estable.
Isótopos del Helio
El Helio (He), este posee una Masa atómica estándar que es de: 4.002602(2) uma. Los isótopos del helio son los que incluyen 2 isótopos naturales y unos 6 isótopos exóticos que son inestables. Existen 8 isótopos conocidos del helio, sin embargo, tan solo el:
-
3He
-
4He
Son los únicos 2 estables. En la atmósfera terrestre existe un átomo de ³He por cada millón de átomos de 4He. A diferencia de los otros elementos, la abundancia isotópica del elemento de helio tiende a variar mucho por su origen, a causa de los diferentes procesos de la formación.
El 4He posee un núcleo inusualmente estable el cual es debido a que los nucleones se encuentran ordenados en unas capas completas. Además, este tipo de isótopo se llegó a formar en las grandes cantidades durante la nucleosíntesis que llegó a ser primordial en el Big Bang.
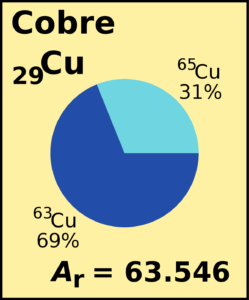
Isótopos del Cobre
El cobre ( 29Cu ) posee unos 2 isótopos que son estables y son el:
-
63Cu
-
65Cu
Esto se encuentran junto con los 27 radioisótopos. El más estable de todos estos es el 67Cu con un periodo de semidesintegración que es de 61,83 horas. El menos estable de todos ellos es el 54Cu con una clase de periodo de semidesintegración de más o menos 75 ns. La gran mayoría poseen periodos de semidesintegración que son menores a 1 minuto.
-
68Cu
-
69Cu
-
71Cu
-
72Cu
-
76Cu
Poseen cada uno 1 isómero nuclear. el 70Cu posee unos 2 isómeros, haciendo un total de 7 isómeros diferentes. El más estable de todos estos es el 68mCu con un tipo de periodo de semidesintegración de unos 3,75 minutos. El menos estable es el 69mCu con un tipo de periodo de semidesintegración de unos 360 ns.
Isótopos del Zinc
El zinc natural que es ( 30Zn ) se encuentra compuesto por unos 5 isótopos estables que son:
-
64Zn
-
66Zn
-
67Zn
-
68Zn
-
70Zn
Siendo el 64Zn el más abundante de los 5 es decir con un 48,6 % de la abundancia natural. Unos 25 radioisótopos se han llegado a caracterizar como los más abundantes y los estables teniendo el 65Zn un tipo de periodo de semidesintegración de 244,26 días, y el 72Zn con un tipo de periodo de semidesintegración de unas 46,5 horas.
El zinc se ha llegado a proponer como un material “salado” para las armas nucleares también esta el caso del cobalto que es otro material salado muy conocido.
Una envoltura de 64Zn que se encuentre enriquecida isotópicamente, la cual es irradiada por el intenso flujo de los neutrones de la alta energía la cual es procedente de 1 arma termonuclear explosiva, llegará a transmutar el isótopo radioactivo 65Zn con 1 vida media de 244 días y es la que produciría aproximadamente unos 1.115 MeV1 de radiación gamma, llegando a aumentar significativamente la radiactividad de la lluvia en el transcurso de varios días.
Tal arma no se ha tenido el conocimiento si ya se ha construido, se ha probado o ha utilizado.
El Cobalto
El cobalto del idioma alemán kobalt, derivada de kobolds, que es los “gnomos” que, según los mineros de Sajonia de época de la Edad Media, eran los espíritus de la tierra que tenían embrujado el mineral, por lo que, este llegaba a parecerse al mena de cobre, no producía este tipo de elemento con el tratamiento habitual, este es un tipo de elemento químico de número atómico 27 y con el símbolo Co que se encuentra situado en el grupo 9 de la tabla periódica de los elementos.
Se han llegado a caracterizar unos 22 radioisótopos siendo los más estables el:
-
Co-60
-
Co-57
-
Co-56
Con los periodos de semidesintegración de unos:
-
5,2714 años
-
271,79 días
-
70,86 días respectivamente.
La masa atómica de los isótopos del cobalto son los que oscilan entre los 50 uma ( Co – 50 ) y los 73 uma ( Co – 73 ). Los isótopos que son más ligeros que el estable ( Co – 59 ) se llegan a desintegrar principalmente por la captura electrónica llegando a originar los isótopos de hierro, mientras tanto que los más pesados que el isótopo estable se llegan a desintegrar por la emisión beta dando lugar a los isótopos de níquel.
Los Isóbaros
Se llaman isóbaros del idioma griego: isos = mismo; barýs = pesado a los diferentes núcleos atómicos que poseen el mismo número de masa ( A ), sin embargo, con un diferente número atómico ( Z ). Las especies químicas tienden a ser distintas a diferencia de los isótopos, ya que el número de los protónes y por consiguiente el mismo número de los electrones llegan a diferir:
- 40 Ca, 40Ar
Isótopos Estables
¿Qué son los isótopos estables? es un llamado nucleido que no suele ser radiactivo esto es a diferencia de los radionucleidos, por lo que no llegan a experimentar de forma espontánea el decaimiento radiactivo. Un elemento químico osee 1 o varios isótopos, de los cuales:
-
Todos
-
Algunos
-
O Ninguno
Pueden llegar a ser isótopos estables. Los isótopos que no tienden a ser estables es decir los llamados radioisótopos, a diferencia de los que si son estables, se llegan a desintegrar para de esta manera dar lugar a otros nucleidos llegando a emitir las partículas o la radiación electromagnética.
Isótopos Estables en la Tabla Periódica
A continuación figura una Tabla Periódica con el número de isótopos estables de cada elemento:
|
H |
He |
||||||||||||||||
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
||||||||||
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
||||||||||
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
|
* |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
||
|
** |
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
||
Usos de los Isótopos
Hoy en día, las aplicaciones que tienen los isótopos, tanto si suelen ser del tipo radioactivo como los isótopos estables, tienden a ser tan extensas, que solo mencionaremos algunas de los usos.
Así como también la destrucción de los tumores que se encuentran en el cuerpo por medio de la radiación con los llamados rayos gamma de Co 60 ó Cs 137; y también se puede destacar la utilización de los isótopos en las rutas metabólicas tanto como en la química orgánica como también en la bioquímica.
Usos en la Agricultura
Se tiende a destacar el uso de los isótopos en el control de las plagas, en la conservación de los alimentos, para llegar a producir las modificaciones genética por medio del uso de los rayos betas y los rayos gammas, que son los que originan 1 serie de mutaciones en las plantas y es lo que las convierten en seres vivos modificados de forma genéticamente.
El cobalto radiactivo, que tiende a emitir radiación gamma las cuales su intensidad tienden a decrecer con la distancia, por lo que las mutaciones que son producidas suelen ser variables; con este tipo de procedimiento se ha podido llegar a obtener nuevas variedades con una mayor concentración de clorofila, las cuales son más resistentes a algunos hongos patógenos, también son mejor adaptadas a los suelos pobres, y a la obtención temprana de los frutos. Para que todo esto tenga un éxito es necesario llegar a usar la dosis adecuada de la radiación. Un ejemplo para lograr esto es el isotopo del nitrógeno – 15.
Usos en la Medicina
Se llegan a emplear en el diagnóstico y también en el tratamiento de las enfermedades, en la esterilización de los productos de usos diarios y frecuente en la clínica y también en la cirugía, etc. Poseen una aplicabilidad que tiende a ser múltiple y las más importantes de ellas son:
-
Radio – 226 se usa en los tratamientos para poder curar el cáncer de la piel.
-
Cobalto – 60 usado en el tratamiento del cáncer ya que este es el que emite 1 radiación con más energía que la del radio.
-
Arsénico – 74 este es frecuentemente usado para la detección de los tumores cerebrales.
-
Fósforo – 32 se llega a usar para poder diagnosticar y llegar a tratar las enfermedades que se encuentran relacionadas con los huesos y también con la médula ósea.
-
Yodo – 131 este es el que sirve para el tratamiento del cáncer de las tiroides.
-
Tecnecio – 99 muy usado en el diagnostico de las enfermedades sin embargo, sobre todo del sistema esqueletico. Puede llegar a usarse para poder identificar los vasos sanguíneos que están bloqueados.
Usos en la Industria
La utilización de los isótopos y las radiaciones en la industria moderna tiende a ser de gran importancia para el buen desarrollo y también las mejora de los procesos, para en el caso de las mediciones, la automatización y también el control de la calidad. Hoy en día, casi todas las ramas de la industria tienden a usar los radioisótopos y las radiaciones de muchas formas distintas entre ellos:
Los Trazadores
Las sustancias radiactivas que se llegan a introducir en un determinado proceso industrial, para posteriormente detectar la trayectoria de los mismos esto es gracias a su emisión radiactiva. Esto es lo que permite llegar a investigar las diversas variables del proceso de los:
-
Caudales
-
Filtraciones
-
Fugas, etc.
De una forma que se llegue a obtener información para poder prolongar la vida de los equipos industriales.
Mejorar la Calidad de Determinados Productos
Inyección de Cinc ( Zn – 64 )
Este es el que reduce la tasa de la dosis radiactiva y en los muchos casos es el que mitiga la iniciación del agrietamiento por la corrosión que se encuentra bajo tensión.
Instrumentación
Son instrumentos radioisotópicos todo los que permiten llegar a realizar las mediciones sin el contacto físico directo. Se usan los indicadores de nivel, de espesor o bien de la densidad.
Tabla Periódica
|
Grupo |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||||||||||||||||||
|
Bloque |
s |
d |
p |
|||||||||||||||||||||||||||||||||
|
↓Período |
·El helio pertenece al bloque s |
|||||||||||||||||||||||||||||||||||
|
1 |
1 |
2 |
||||||||||||||||||||||||||||||||||
|
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||||||||||||||||||||||||||||
|
3 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||||||||||||||||||||||||||||
|
4 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
31 |
32 |
33 |
34 |
35 |
36 |
||||||||||||||||||
|
5 |
37 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
54 |
||||||||||||||||||
|
6 |
55 |
56 |
57-71 |
72 |
73 |
74 |
75 |
76 |
77 |
78 |
79 |
80 |
81 |
82 |
83 |
84 |
85 |
86 |
||||||||||||||||||
|
7 |
87 |
88 |
89-103 |
104 |
105 |
106 |
107 |
108 |
109 |
110 |
111 |
112 |
113 |
114 |
115 |
116 |
117 |
118 |
||||||||||||||||||
|
Bloque |
f |
d |
||||||||||||||||||||||||||||||||||
|
* |
Lantánidos |
57 |
58 |
59 |
60 |
61 |
62 |
63 |
64 |
65 |
66 |
67 |
68 |
69 |
70 |
71 |
||||||||||||||||||||
|
** |
Actínidos |
89 |
90 |
91 |
92 |
93 |
94 |
95 |
96 |
97 |
98 |
99 |
100 |
101 |
102 |
103 |
||||||||||||||||||||
Isótopos más Abundantes en el Sistema Solar
En la presente tabla podrás observar todos y cada uno de los isótopos más Abundantes en el Sistema Solar
|
Isótopo |
Núcleos por |
|---|---|
|
Hidrógeno-1 |
705 700 |
|
Hidrógeno -2 |
23 |
|
Helio-4 |
275 200 |
|
Helio-3 |
35 |
|
Oxígeno-16 |
5920 |
|
Carbono-12 |
3032 |
|
Carbono-13 |
37 |
|
Neón-20 |
1548 |
|
Neón-22 |
208 |
|
Hierro-56 |
1169 |
|
Hierro-54 |
72 |
|
Hierro-57 |
28 |
|
Nitrógeno-14 |
1105 |
|
Silicio-28 |
653 |
|
Silicio-29 |
34 |
|
Silicio-30 |
23 |
|
Magnesio-24 |
513 |
|
Magnesio-26 |
79 |
|
Magnesio-25 |
69 |
|
Azufre-32 |
39 |
|
Argón-36 |
77 |
|
Calcio-40 |
60 |
|
Aluminio-27 |
58 |
|
Níquel-58 |
49 |
|
Sodio-23 |
33 |
Aplicaciones de los Isótopos
Estas son varias de las aplicaciones y los usos que se les dan a los diversos tipos de isótopos en las diferentes áreas, como por ejemplo:
El Cobalto – 60
Este se utiliza en el área de la medicina para los tratamientos del cáncer debido a que emite una radiación con una fuerza y cantidad mayor de energía que la que emite el radio y también porque tiende a ser el más barato que este.
El Arsénico – 73
El Bromo – 82
Este es utilizado en el área de la hidrología el cual es úÚtil para llegar a hacer los tales como la determinación de los caudales de agua, las direcciones de los flujos de agua y los tiempos de residencia en las aguas superficiales y también las subterráneas, la determinación de la dinámica de los lagos y las fugas en los embalses.
El Oro – 198
Este es de una gran aplicación en la industria del petróleo para realizar las perforación de los pozos para búsqueda del petróleo, en los estudios de la recuperación secundaria de petróleo, que se llegan a adelantar en la determinación de la producción incremental y de la industria petroquímica en general.
El Fósforo – 32
Este es otro de los isótopo usados en el área de la medicina ya que es el que emite los rayos beta y se utiliza para llegar a diagnosticar y también para tratar las enfermedades relacionadas con los huesos y con la médula ósea.
El Escandio – 46
Este es aplicable en los estudios de la sedimentología y la Geologóa en los análisis de los suelos.
El Lantano – 140
El Mercurio – 147
Este es para la aplicación en las celdas electrolíticas.
El Nitrógeno – 15
Este isótopo se llega a emplear muy a menudo en la investigación médica y también en la agricultura. También se suele emplear habitualmente en la espectroscopia de las resonancias magnéticas nucleares ( NMR ).
El Yodo – 131
Este es uno de los radionucleidos que tienden a ser involucrados en las pruebas nucleares atmosféricas, que llegaron a empezar en el año 1945. Este es el que aumenta el riesgo de padecer cáncer y también las posiblemente otras enfermedades de las tiroides y todas aquellas causadas por las deficiencias hormonales tiroideas.
El Radio – 226
Es usado en el área de la medicina para la realización de los tratamientos para llegar a curar el cáncer de la piel.
El Tritio, 3H
El tritio posee aplicaciones médicas como por ejemplo el rastreador ya que al llegar a descomponerse, como se ha llegado a ver, este tiende a emitir electrones de baja energía sin embargo no rayos γ que tiende a ser un tipo de radiación mucho más peligrosa. La bomba de hidrógeno en verdad tiende a ser una bomba de tritio.
El Tecnecio – 99
Utilización de las Propiedades Químicas
En el marcado isotópico, se utilizan isótopos inusuales como los marcadores de las reacciones químicas. Los isótopos que son añadidos tienden a reaccionan químicamente igual que los que se encuentran presentes en la reacción, sin embargo, después se pueden llegar a identificar por la espectrometría de las masas o por la espectroscopia infrarroja. Si se utilizan radioisótopos, se pueden llegar a detectar también esto es gracias a las radiaciones que suelen emitir. Los procesos de la separación isotópica o el enriquecimiento isotópico tienden a representar un gran desafío.